Références scientifiques Vitamine B9
1. Introduction:
La vitamine B9, communément désignée sous le terme générique de folates, est un micronutriment hydrosoluble essentiel appartenant au complexe vitaminique B. En raison de l'incapacité du corps humain à synthétiser cette vitamine de novo, un apport alimentaire régulier est impératif pour assurer la synthèse de l’ADN, la division cellulaire et la formation des globules rouges. Elle est particulièrement importante lors des périodes de croissance rapide, notamment pendant l’enfance et la grossesse, car elle contribue au bon développement du système nerveux du fœtus (1,2).
1.1- Sources de Vitamine B9
Le règne végétal constitue la source primaire de folates pour la population humaine, les concentrations les plus élevées étant localisées au sein des végétaux. Les légumes à feuilles vertes et les crucifères, ainsi que les légumineuses telles que les lentilles, les pois chiches et les haricots, représentent des vecteurs alimentaires essentiels (3). Bien que les sources végétales soient prédominantes, certains produits d'origine animale, notamment le foie, agissent comme des organes de stockage hautement concentrés (4), au même titre que la levure de bière qui présente une teneur en vitamine B9 particulièrement élevée (5).Compte tenu des teneurs parfois élevées dans le foie, cette consommation est déconseillée pendant la grossesse.
1.2- Formes de Vitamine B9
La compréhension de la vitamine B9 nécessite une distinction rigoureuse entre ses différentes formes : les folates naturels présents dans la biomasse végétale, l’acide folique utilisé en fortification alimentaire, et le 5-méthyltétrahydrofolate (5-MTHF), qui est la forme métaboliquement active. Cette distinction est d'autant plus pertinente que la capacité individuelle à utiliser ces formes peut être limitée par des variations génétiques spécifiques influençant la biodisponibilité réelle du nutriment.
1.2.1- Les folates:
Dans l'alimentation naturelle, la vitamine B9 se présente principalement sous forme de polyglutamates réduits. Ces formes sont biologiquement actives mais chimiquement fragiles et doivent être transformées au cours de la digestion en formes simples (monoglutamates) pour pouvoir être absorbées et utilisées par l’organisme. D'un point de vue biochimique, leur absorption nécessite l'action d'une enzyme ancrée à la bordure en brosse de l'intestin grêle, la folylpolyglutamate hydrolase. Ce processus hydrolytique transforme les polyglutamates en monoglutamates, seule forme capable d'être transportée par le transporteur de folate couplé aux protons (PCFT) (6). La littérature scientifique souligne que cette étape digestive, combinée à la grande instabilité des folates naturels face à la chaleur et à l'oxydation (7), réduit leur biodisponibilité réelle à environ 50 % de celle des formes de synthèse (8).
1.2.2- L’acide folique:
L'acide folique, étant une forme monoglutamate plus stable, est absorbé plus efficacement par les transporteurs intestinaux (PCFT). Sa prédominance dans l'industrie pharmaceutique s'explique par sa stabilité thermique exceptionnelle.
Pour devenir biologiquement actif, l'acide folique doit subir deux réductions successives par l'enzyme dihydrofolate réductase (DHFR) pour être transformé en tétrahydrofolate (THF), l'activité de la DHFR chez l'humain est extrêmement lente et facilement saturable(2). Par conséquent, une ingestion dépassant 200 à 400 µg peut saturer cette voie métabolique, entraînant l'apparition d'acide folique non métabolisé (UMFA) dans la circulation systémique. Par conséquent, une présence massive d'UMFA peut être le marqueur d'une incapacité de l'organisme à générer assez de folates actifs, laissant l'homocystéine s'accumuler (9).
1.2.3- Le 5-MTHF:
Le 5-MTHF est la forme biologiquement active finale qui circule dans le compartiment systémique. Sa synthèse se produit principalement dans le foie et les cellules intestinales à partir du 5,10-méthylènetétrahydrofolate,métabolite dérivé du THF. Cette conversion est catalysée par l'enzyme méthylènetétrahydrofolate réductase (MTHFR), qui utilise le FAD comme cofacteur et le NADPH comme donneur d'électrons pour réduire irréversiblement le groupement méthylène en groupement méthyle. Une fois formé, le 5-MTHF est libéré dans la circulation systémique, constituant plus de 90 % des folates plasmatiques, car il est la seule forme capable de traverser la barrière hémato-encéphalique pour alimenter le système nerveux central.
1.3- Besoins accrus en vitamine B9 et adéquation des apports
Les besoins en vitamine B9 sont accrus chez certaines populations, en particulier chez les femmes en âge de procréer et pendant la période périconceptionnelle, en raison du rôle central des folates dans la division cellulaire, la synthèse de l’ADN et le métabolisme des unités monocarbonées. Or, les données de consommation montrent que les apports alimentaires spontanés sont fréquemment insuffisants dans ces populations. En France, les enquêtes nutritionnelles indiquent que les apports moyens en vitamine B9 chez les femmes de 18 à 44 ans restent inférieurs aux références nutritionnelles pour la population, conduisant à un statut folique suboptimal et justifiant le recours à une supplémentation ciblée (10). Ce statut insuffisant est à mettre en relation avec l’incidence persistante des anomalies de fermeture du tube neural (AFTN), qui demeure stable malgré des apports alimentaires jugés globalement adéquats. Les données nationales rapportent une incidence d’environ 13,5 cas pour 10 000 grossesses, incluant les naissances vivantes, les mort-nés et les interruptions médicales de grossesse, soulignant les limites de l’alimentation seule pour couvrir les besoins physiologiques en folates au moment critique du développement embryonnaire (4,10).
Face à ce constat, les autorités sanitaires ont souligné l’intérêt de stratégies visant à améliorer le statut en folates des femmes susceptibles de devenir enceintes, notamment par la supplémentation pendant la période périconceptionnelle. Les analyses de la littérature montrent que ces approches sont associées à une réduction significative du risque d’AFTN, avec un niveau de preuve jugé modéré à élevé (11).
Par ailleurs, certaines personnes présentent des besoins fonctionnellement augmentés en folates, liés à une utilisation métabolique moins efficiente, notamment en présence de polymorphismes génétiques affectant le métabolisme des folates.
Dans ces situations, des apports alimentaires standards peuvent ne pas suffire à atteindre un statut folique optimal (12). Une supplémentation ciblée avec des formes de folates directement utilisables par l’organisme, telles que le 5‑MTHF (Quatrefolic®), à raison d’une dose quotidienne de 400 µg/j, est considérée comme suffisante pour couvrir les besoins des populations à besoins accrus et contribuer ainsi à la prévention des anomalies de fermeture du tube neural.
1.4- Conséquences sur la santé associées à la carence et à l’excès de vitamine B9.
La vitamine B9 joue un rôle central dans la division cellulaire, la synthèse de l’ADN et le développement du système nerveux. Un apport adéquat est donc indispensable au maintien de l’intégrité des tissus et à une croissance normale, en particulier au cours de la grossesse et de l’enfance. Des apports insuffisants comme excessifs peuvent avoir des conséquences cliniques importantes. C’est pourquoi l’évaluation des effets de la carence et de l’excès de vitamine B9 constitue un enjeu majeur de santé publique.
1.4.1- Carence :
La carence en vitamine B9 survient lorsque les apports sont insuffisants ou que les besoins sont augmentés, notamment pendant la grossesse. En raison de son rôle essentiel dans la synthèse de l’ADN et la division cellulaire, un déficit peut rapidement entraîner des effets cliniques importants.
1.4.1.1- Anémie mégaloblastique
La carence en vitamine B9 ralentit la division de toutes les cellules de l’organisme et entraîne la production de globules rouges anormalement grands et immatures, conduisant principalement à une anémie mégaloblastique (13,14). Lorsque le taux de folates sériques diminue puisque les réserves s’épuisent, la moelle osseuse produit des globules rouges de grande taille avec une maturation nucléaire anormale. Après plusieurs semaines, on observe une augmentation du volume globulaire moyen, une baisse de l’hémoglobine et du nombre de globules rouges, ainsi qu’une diminution des granulocytes et des plaquettes (13,14).
Un signe précoce et très spécifique est l' hypersegmentation des neutrophiles (cinq à six lobes au lieu de deux à quatre), qui apparaît souvent avant la macrocytose (14).
Bien que l’anémie mégaloblastique soit typique d’une carence en folates, le même tableau clinique peut aussi résulter d’une carence en vitamine B12 (cobalamine) en raison des interactions métaboliques entre ces deux vitamines (13). La mégaloblastose peut également toucher les cellules épithéliales du tractus digestif et altérer l’absorption des folates, aggravant ainsi la carence (15).
Enfin, une carence en folates peut être associée à des symptômes neuropsychiques tels que l’irritabilité et les troubles de la mémoire, généralement d’intensité légère et moins fréquents que l’anémie (14).
1.4.1.2- Anomalies du tube neural (ATN).
Pendant la période périconceptionnelle et les premières semaines de grossesse, une carence maternelle en vitamine B9 augmente fortement le risque d’anomalies de fermeture du tube neural (ATN) chez le fœtus, qui incluent des malformations graves telles que l’anencéphalie et le spina bifida (16). Ces anomalies surviennent très tôt, généralement entre la 3ᵉ et la 4ᵉ semaine de gestation lors de la fermeture du tube neural, souvent avant que la femme ne sache qu’elle est enceinte, ce qui explique l’importance d’un statut en folates optimal avant la conception.La prévention des ATN par une supplémentation en acide folique avant la grossesse et durant le premier trimestre est bien documentée. Des études et revues systématiques montrent qu' une supplémentation périconceptionnelle en folates réduit significativement le risque de survenue et de récidive des anomalies du tube neural, ce qui constitue une stratégie de santé publique reconnue pour diminuer l’incidence de ces malformations graves (11).
1.4.2- Excès des folates :
1.4.2.1- Supplémentation en vitamine B9 et carence en vitamine B12 : intérêt du Quatrefolic® :
Les folates naturellement présents dans les aliments ne sont pas associés à des effets indésirables, même à des apports élevés (17). En revanche, les préoccupations de sécurité concernent principalement l’acide folique, la forme synthétique utilisée dans les compléments alimentaires et les aliments enrichis.
Un apport élevé en acide folique chez une personne présentant une anémie mégaloblastique due à une carence en vitamine B12 peut corriger les anomalies sanguines sans corriger le trouble métabolique sous-jacent. En effet, l’acide folique permet de restaurer partiellement la synthèse de l’ADN dans la moelle osseuse, ce qui normalise la production des globules rouges et fait disparaître l’anémie (Figure 1B). Cependant, la carence en vitamine B12 persiste et la méthionine synthase, une enzyme dépendante de la B12, reste inactive. La conversion de l’homocystéine en méthionine demeure donc altérée, ce qui entraîne une accumulation d’homocystéine et une production insuffisante de méthionine, indispensable au maintien de la myéline et de l’intégrité du système nerveux. Ainsi, malgré l’amélioration des paramètres hématologiques pour la supplémentation, des lésions neurologiques peuvent continuer à progresser, parfois de manière irréversible (13). Ce mécanisme explique pourquoi le risque principal associé à un excès d’acide folique n’est pas une toxicité directe, mais le retard du diagnostic et du traitement d’une carence en vitamine B12, avec des conséquences neurologiques graves (6).
À l’inverse, la supplémentation en 5-méthyltétrahydrofolate (Quatrefolic®) ne permet pas de contourner le blocage métabolique induit par une carence en vitamine B12 et ne corrige pas l’anémie mégaloblastique dans ce contexte (Figure 1C). Elle ne masque donc pas la carence en cobalamine, ce qui permet un diagnostic approprié et la mise en place rapide d’une supplémentation en vitamine B12, seule capable de restaurer le métabolisme de la méthionine et de prévenir les complications neurologiques (18).
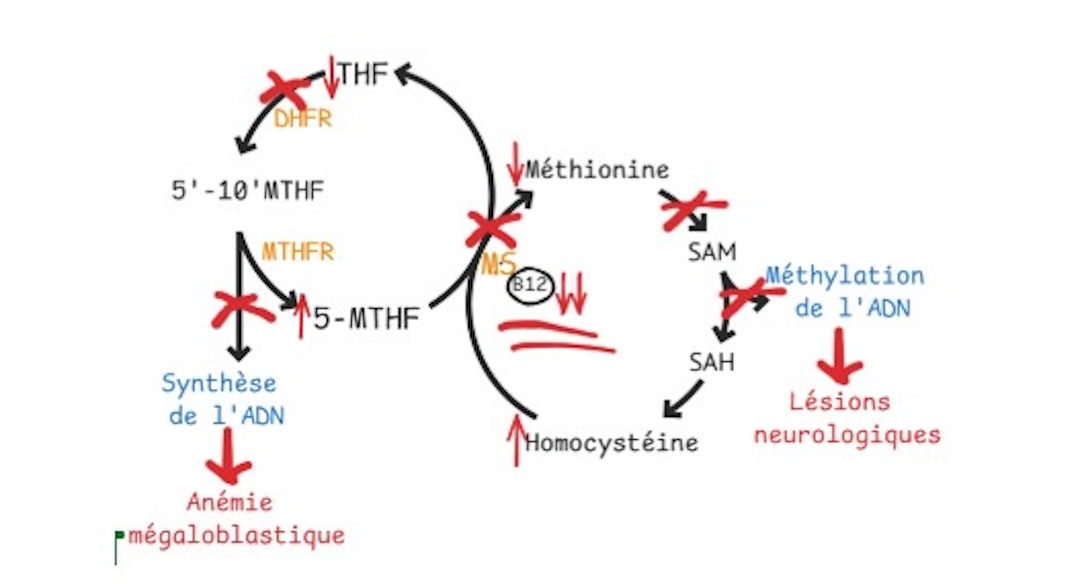
Figure 1A : Carence en vitamine B12 se manifestant par une anémie mégaloblastique.
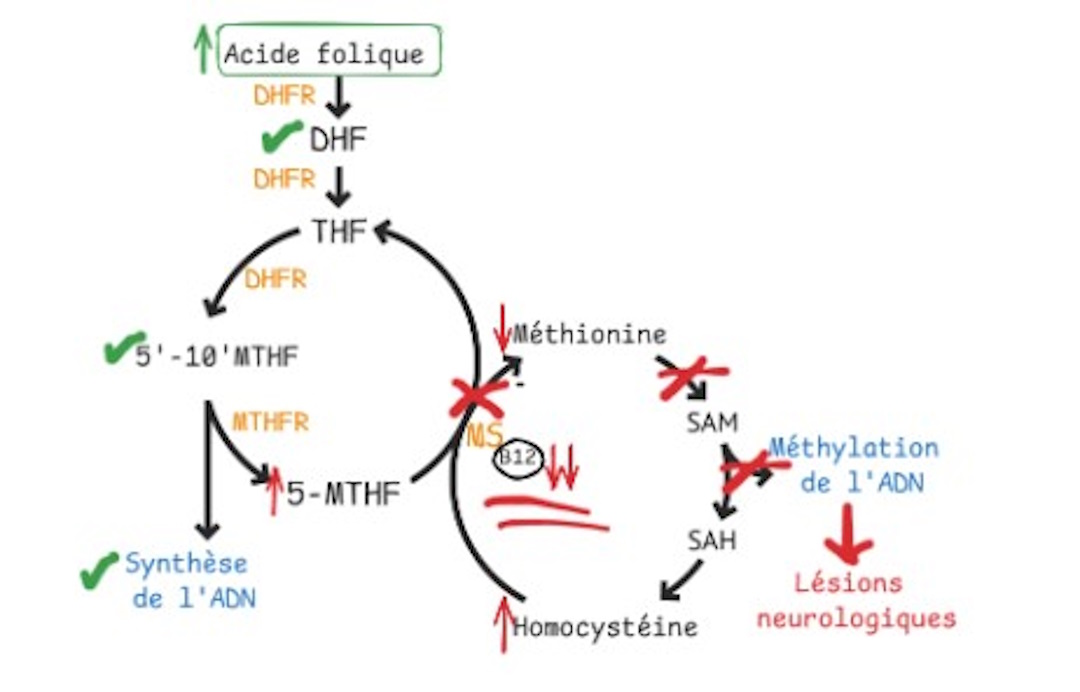
Figure 1B : Carence en vitamine B12 masquée par l’apport d’acide folique
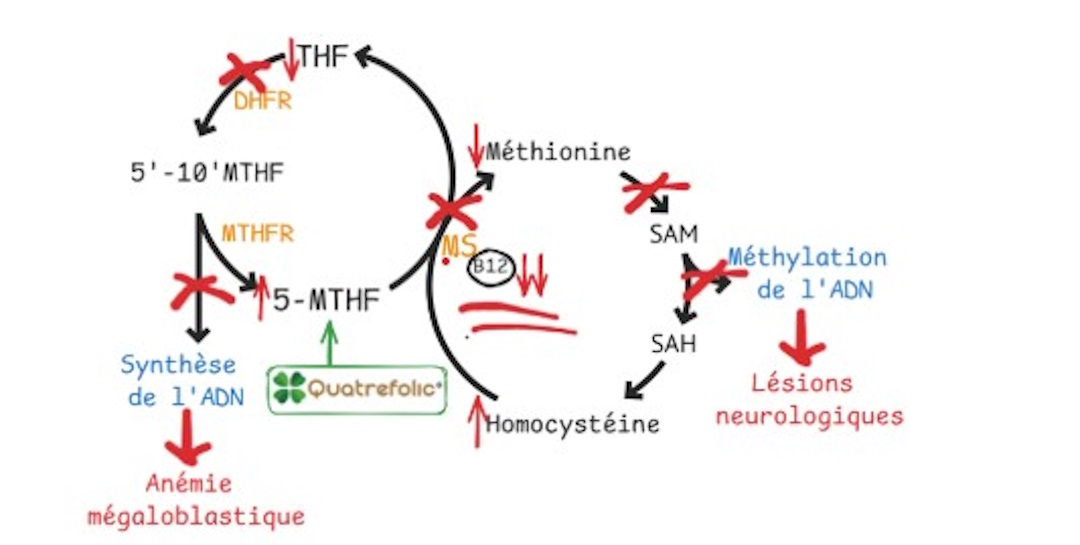
Figure 1C : Quatrefolic® n’altère pas le diagnostic d’une carence en vitamine B12.
1.5- Biomarqueurs du statut et de la fonction des folates.
1.5.1- Folates sériques:
La concentration de folates dans le sérum ou le plasma est un marqueur sensible de l’apport alimentaire récent, mais elle varie en fonction des repas et du moment du prélèvement (19). Une mesure isolée n’est donc pas suffisante pour évaluer le statut en folates ni les réserves de l’organisme. Après une supplémentation régulière en acide folique ou en 5-MTHF, un état d’équilibre est atteint après environ 12 à 14 semaines, moment à partir duquel le folate sérique reflète mieux le statut vitaminique (20,21). Un seuil de ≤ 6,8 nmol/L (3 ng/mL) a été établi comme indicatif d’une carence associée à l’épuisement des réserves et à des signes cliniques (14). Cependant, une seule mesure ne permet pas de distinguer une carence d’une diminution transitoire des apports, et doit être confirmée par des mesures répétées ou être combinée à d’autres biomarqueurs, tels que les folates érythrocytaires et la homocystéine plasmatique (22,23).
1.5.2- Folates érythrocytaires:
Le folate érythrocytaire est considéré comme le biomarqueur le plus fiable du statut en folates, car il reflète les réserves tissulaires à long terme(24). Les folates sont incorporés dans les globules rouges lors de leur maturation et restent stables durant leur durée de vie (environ 120 jours)(25). Des concentrations inférieures à 317 nmol/L (140 ng/mL) indiquent une carence(26). Une méta-analyse de 19 essais contrôlés randomisés a montré que la supplémentation en acide folique (50–400 µg/jour) augmente de façon dose-dépendante le folate sérique et le folate érythrocytaire(27).
1.5.3- Homocystéine plasmatique:
Sur le plan fonctionnel, la concentration plasmatique totale d’homocystéine est un biomarqueur de la fonction des folates, car ceux-ci participent à la reméthylation de l’homocystéine en méthionine (22,28). Une supplémentation en acide folique (200 µg/jour) permet une réduction maximale de l’homocystéine (29). Toutefois, l’homocystéine n’est pas spécifique des folates, car elle est aussi influencée par la vitamine B12, la vitamine B6, la riboflavine et d’autres facteurs métaboliques et physiologiques (30,31). Des concentrations de folates sériques ≥ 10 nmol/L et de folates érythrocytaires ≥ 340 nmol/L sont associées à une fonction métabolique adéquate (23,28). Enfin, la macrocytose (augmentation du volume moyen des globules rouges) apparaît seulement à un stade avancé de carence en folates (25,26).
En conclusion, le statut en folates ne peut être évalué de manière fiable à partir d’un seul biomarqueur. Bien que le folate érythrocytaire soit le biomarqueur le plus fiable du statut en folates, une évaluation complète nécessite la combinaison de plusieurs indicateurs : le folate sérique (apport récent), le folate érythrocytaire (réserves à long terme) et l’homocystéine plasmatique (fonction métabolique) (22,23).
1.6- Vulnérabilité génétique
Certaines variations génétiques (polymorphismes) des gènes codant pour les enzymes impliquées dans le métabolisme des folates influencent le statut en folates et ses conséquences physiologiques (32).
Le polymorphisme ayant l’impact le plus important est le C677T, correspondant à une substitution nucléotidique C→T en position 677, entraînant le remplacement d’une alanine par une valine (Ala222Val) dans l’enzyme MTHFR. La MTHFR catalyse la conversion du 5,10-méthylène-tétrahydrofolate en 5-méthyltétrahydrofolate (5-MTHF), une étape clé du cycle des folates fournissant les groupements méthyle nécessaires au métabolisme de l’homocystéine et aux réactions de méthylation. Cette substitution rend l’enzyme thermolabile et réduit son activité enzymatique, ce qui favorise une concentration plasmatique accrue d’homocystéine et des niveaux plus bas de 5-MTHF (33).
Les effets fonctionnels de ce polymorphisme dépendent du génotype (34–36) :
- Les individus hétérozygotes (CT) conservent une activité enzymatique réduite d’environ 60–65 % par rapport à l’activité normale.
- Les individus homozygotes (TT) présentent une diminution encore plus marquée, avec ≈ 30–40 % de l’activité enzymatique normale.
Des méta-analyses indiquent que le génotype 677TT est associé à une augmentation du risque de grossesses affectées par des anomalies du tube neural (37), de complications de la grossesse (38), d’accident vasculaire cérébral (39), de schizophrénie (40,41) et de dépression (41) .
Le polymorphisme MTHFR C677T présente une grande variabilité géographique et une prévalence élevée dans de nombreuses populations. Des méta-analyses indiquent que l’allèle T est présent chez environ 40 % de la population mondiale (42), avec des fréquences nettement plus élevées (>60 %) dans certaines régions d’Asie du Nord, tandis que dans certaines populations européennes la fréquence de l’allèle T peut atteindre environ 40 % (43–45).
Ces altérations biochimiques sont particulièrement marquées en cas de faible apport en folates ; en revanche, aucune différence de folates sériques entre génotypes n’est observée lorsque l’apport dépasse 600 µg EFA/jour (46).
D’autres polymorphismes impliqués dans le métabolisme des folates — tels que MTHFR 1298A→C, méthionine synthase 2756A→G, méthionine synthase réductase 66A→G, transporteur réduit des folates 180A→G, délétion de 19 paires de bases de la dihydrofolate réductase et glutamate carboxypeptidase II 1561C→T — ont été associés à de légères perturbations des biomarqueurs des folates, mais leur impact clinique reste incertain (32).
1.6.1- Intérêt de choisir QuatreFolic®.
Contrairement à l’acide folique, le 5-méthyltétrahydrofolate (5-MTHF) est la forme biologiquement active du folate et peut être directement utilisée par les cellules sans nécessiter la réduction catalysée par la MTHFR. Cette caractéristique est particulièrement importante chez les individus porteurs de polymorphismes du gène MTHFR, notamment la variante C677T, qui présente une capacité réduite à convertir l’acide folique en 5-MTHF. L’apport direct de 5-MTHF permet ainsi de soutenir efficacement la reméthylation de l’homocystéine et les réactions de méthylation, sans risque d’accumulation d’acide folique non métabolisé.
2. Actions et mécanismes d’action
2.1- Support de la division cellulaire et de l'hématopoïèse
Mécanisme d'action : Synthèse d’ADN(47)
Les folates sont des cofacteurs essentiels du métabolisme des unités monocarbonées, nécessaires à la synthèse des purines et des pyrimidines, bases fondamentales de l’ADN et de l’ARN. Cette participation est indispensable à la duplication de l’ADN, à la division cellulaire et au renouvellement des tissus à fort turnover, notamment la moelle osseuse et le sang (synthèse de lymphocytes et érythropoïèse) (48). Une carence en folates perturbe ces voies, ce qui se manifeste notamment par une anémie mégaloblastique liée à l’altération de la synthèse d’ADN dans les précurseurs hématopoïétiques.
Implication clinique :
Indispensable aux tissus à renouvellement rapide (moelle osseuse, muqueuse digestive).
2.2- Participation à la formation du tube neural
Mécanisme d'action : Méthylation d’ADN(49)
Les folates sont indispensables au cycle de la méthionine et à la production de S-adénosyl-méthionine (SAM), le principal donneur de groupements méthyle pour la méthylation de l’ADN. Cette régulation épigénétique est cruciale pendant l’embryogenèse, notamment lors de la fermeture du tube neural. Une insuffisance en folates autour de la conception perturbe la méthylation et la prolifération cellulaire, augmentant le risque de malformations du tube neural. Une supplémentation périconceptionnelle en folates réduit significativement ce risque.
Implication clinique :
-Prévention des ATN : La méthylation est critique pour la fermeture du tube neural chez l'embryon.
-Cardio-protection : Évite l'accumulation d'homocystéine (toxique pour l'endothélium).
2.3- Modulation de la synthèse des neurotransmetteurs
Mécanisme d'action : Régénération de la BH4.
Les folates participent indirectement à la synthèse des neurotransmetteurs via leur rôle dans le métabolisme des unités monocarbonées et la régénération de la tétrahydrobioptérine (BH4). La BH4 est un cofacteur essentiel des hydroxylases qui catalysent la formation de la dopamine, de la noradrénaline et de la sérotonine à partir de leurs acides aminés précurseurs. Un statut insuffisant en folates peut donc altérer la disponibilité de BH4 et perturber la biosynthèse des neurotransmetteurs.
Implication clinique:
-Le L-méthylfolate est utilisé en complément des antidépresseurs pour potentialiser la réponse synaptique pour l'endothélium.
3.Nécessité de la supplémentation selon le contexte.
3.1- Healthy aging (Vieillissement en bonne santé).
Avec l’âge, la prévalence des états de carence ou de statut marginal en folate augmente, notamment en raison de l’alimentation, de la malabsorption ou d’une réduction des apports totaux. Chez les personnes âgées, un faible statut en folates est associé à une élévation de l’homocystéine, un marqueur impliqué dans des processus de vieillissement vasculaire et neurocognitif (50).
Le déficit en folates constitue un problème majeur de santé publique chez les personnes âgées. Les enquêtes nutritionnelles européennes et nord-américaines montrent qu’une proportion importante des sujets de plus de 65 ans présente soit une carence, soit un statut marginal en folates, lié à une inadéquation chronique entre apport alimentaire, absorption intestinale et utilisation cellulaire (4,22,28).
3.1.1- Pourquoi la carence en folates augmente avec l’âge ?
a) Hypochlorhydrie gastrique
L’hypochlorhydrie, fréquente chez les personnes âgées, réduit la biodisponibilité des folates alimentaires. Elle diminue l’activité de la folate-conjugase, nécessaire pour libérer les folates des polyglutamates alimentaires, perturbe le transport des folates, qui dépend d’un gradient de protons, favorise le SIBO (small intestinal bacterial overgrowth), les bactéries intestinales consommant les folates qui auraient dû être absorbés par l’organisme (19,28).
b) Interactions médicamenteuses
De nombreux médicaments utilisés chez les personnes âgées interfèrent avec le métabolisme du folate (metformine, inhibiteurs de la pompe à protons (IPP), anti-épileptiques, diurétiques, méthotrexate, etc.) ce qui contribue à une réduction du statut en folates et à une augmentation de l’homocystéine (4,22).
c) Polymorphisme MTHFR et vieillissement
Le polymorphisme MTHFR C677T, fréquent dans la population, réduit la conversion du 5,10-méthylène-THF en 5-méthyl-THF, la forme biologiquement active du folate.
Chez les personnes âgées, ce déficit enzymatique a un impact plus marqué en raison de la baisse globale du statut nutritionnel, entraînant une accumulation d’homocystéine, une carence cellulaire en groupements méthyle, essentiels à la méthylation de l’ADN et au fonctionnement neuronal (4,34,36).
Même en l’absence de signes cliniques, une insuffisance modérée en folates entraîne une élévation de l’homocystéine plasmatique et une hypométhylation de l’ADN, deux mécanismes impliqués dans le développement de maladies chroniques telles que les maladies cardiovasculaires, le diabète de type 2 et le déclin cognitif (4,28).
3.1.2- Rôle dans la santé cardiovasculaire.
Les folates jouent un rôle clé dans la réduction de l’homocystéine, un facteur de risque cardiovasculaire indépendant. La méta-analyse de Humphrey et al. (2008) a montré qu’une réduction de 3 µmol/L d’homocystéine est associée à une diminution du risque de cardiopathie ischémique (~ −16 %), de thrombose veineuse profonde (~ −25 %), et d’accident vasculaire cérébral (~ −24 %). Inversement, chaque augmentation de 5 µmol/L d’homocystéine augmente le risque d’événements coronariens d’environ 20 % (51).
Plusieurs mécanismes physiopathologiques ont été proposés pour expliquer ces associations : l’homocystéine élevée est impliquée dans le stress oxydatif, l’activation des plaquettes et la dysfonction endothéliale, ce qui favorise l’athérosclérose et l’instabilité des plaques. Les folates, en facilitant la reméthylation de l’homocystéine en méthionine, contribuent à maintenir un profil métabolique protecteur pour le système cardiovasculairen (52–55).
Intérêt de choisir QuatreFolic®
Une étude pharmacocinétique chez des patients atteints de maladie coronarienne a montré que le 5-méthyltétrahydrofolate (5-MTHF) présente une biodisponibilité nettement supérieure à celle de l’acide folique, avec des concentrations plasmatiques environ sept fois plus élevées après supplémentation, y compris chez les porteurs du polymorphisme MTHFR 677C>T(56). Comme le 5-MTHF est la forme biologiquement active impliquée dans la reméthylation de l’homocystéine, ces résultats suggèrent qu’un apport direct en 5-MTHF est plus efficace pour soutenir les voies métaboliques liées au risque cardiovasculaire que l’acide folique.
3.1.3- Rôle dans la prévention du diabète type II.
Des travaux expérimentaux et cliniques suggèrent également que l’hyperhomocystéinémie contribue à la résistance à l’insuline et à la dysfonction des cellules β pancréatiques, favorisant le diabète de type 2 (57).
Les essais randomisés montrent une amélioration modeste de marqueurs d’insulino-résistance (insuline à jeun, HOMA-IR) (58).
3.1.4- Rôle dans la fonction cognitive et psychologique du cerveau.
Les folates contribuent à une fonction psychologique normale et au maintien des fonctions cognitives par plusieurs mécanismes biochimiques complémentaires. Ils participent aux réactions de méthylation, indispensables à la régulation de l’expression génique et à la synthèse de composés nécessaires au fonctionnement du système nerveux.
Les folates interviennent également dans la synthèse de l’ADN, le métabolisme des acides aminés et la production de cofacteurs indispensables à l’activité neuronale et à la transmission nerveuse, soutenant ainsi la plasticité synaptique et la signalisation neuronale.
En outre, les folates jouent un rôle clé dans la reméthylation de l’homocystéine en méthionine, contribuant à la production de S-adénosyl-méthionine (SAM), le principal donneur de groupes méthyle du cerveau. Ce mécanisme participe indirectement à la protection des neurones, à l’intégrité de la fonction neurovasculaire et à la prévention de la neurotoxicité liée à l’hyperhomocystéinémie (4,23,59).
3.2- Performances sportives.
3.2.1. Les folates comme indispensables pour le métabolisme énergétique.
La nutrition joue un rôle déterminant dans l’optimisation de la performance sportive, et l’activité physique régulière modifie les besoins en micronutriments.
La vitamine B9 joue un rôle essentiel dans le métabolisme énergétique, même si elle n’est pas directement une vitamine « productrice d’énergie » comme la B1, B2 ou B3. Son rôle principal est lié au métabolisme des unités monocarbonées, c’est-à-dire le transfert de petits fragments de carbone nécessaires à de nombreuses réactions biochimiques, tels que la régénération de l’ATP(4).
Tout d’abord, la vitamine B9 est indispensable à la synthèse de l’ADN, de l’ARN ainsi que pour la prolifération cellulaire (60), processus fondamentaux assurant le renouvellement des tissus musculaires et hématopoïétiques chez le sportif (61,62). Ce renouvellement conditionne la capacité de ces tissus à maintenir une activité métabolique élevée et, par conséquent, une production énergétique efficace.
Bien qu’aucune étude n’ait évalué directement l’impact des génotypes MTHFR ou de l’apport alimentaire en folates sur la performance physique, il a été montré que l’hyperhomocystéinémie est associée à une diminution de la fonction musculaire (63).
Ensuite, la B9 intervient dans la formation des globules rouges. Une carence en folates entraîne une anémie, ce qui réduit le transport de l’oxygène vers les tissus. Moins d’oxygène signifie une diminution de la respiration cellulaire, donc une baisse de la production d’ATP, la molécule énergétique des cellules (64).
La vitamine B9 participe aussi au métabolisme de certains acides aminés, notamment l’homocystéine. En collaboration avec les vitamines B12 et B6, elle permet de recycler l’homocystéine en méthionine, un acide aminé important pour la synthèse des protéines et de nombreuses molécules impliquées dans le métabolisme énergétique (28).
Enfin, la vitamine B9 ne produit pas l’énergie directement, mais elle est indispensable au bon fonctionnement des voies métaboliques qui permettent aux cellules de fabriquer et d’utiliser l’ATP. Une carence se traduit souvent par fatigue, faiblesse et baisse des performances physiques et intellectuelles.
3.2.2. Folates, globules rouges et capacité de transport de l’oxygène.
Le folate est un nutriment hématopoïétique essentiel impliqué dans la synthèse des globules rouges. Pendant l’exercice, la fonction principale des globules rouges est d’assurer le transport de l’oxygène (O₂) des poumons vers les tissus actifs et l’élimination du dioxyde de carbone (CO₂) produit par le métabolisme musculaire(64).
Chez les sportifs, une forte corrélation existe entre la concentration d’hémoglobine et la consommation maximale d’oxygène (VO₂ max). Des taux élevés d’hémoglobine augmentent la quantité d’oxygène pouvant être délivrée aux tissus, ce qui est un déterminant majeur de la performance d’endurance. Les paramètres clés sont la concentration et la masse totale d’hémoglobine, l’hématocrite et le volume total des globules rouges circulant (61,64).
Une carence en folates altère l’érythropoïèse, diminue la masse globulaire et réduit la capacité de transport de l’oxygène, compromettant directement la performance physique (61).
3.2.3. Folates, homocystéine et exercice intense.
Le lien entre activité physique, statut en folates et homocystéine plasmatique dépend du type, de l’intensité et de la durée de l’exercice.
Les activités d’endurance prolongées (par exemple triathlon, marathon) induisent une forte demande métabolique en folates liée à l’augmentation du renouvellement cellulaire et du métabolisme des acides aminés, ce qui peut entraîner une élévation de l’homocystéine plasmatique si les apports sont insuffisants (4,59).
Une augmentation chronique de l’homocystéine est associée à un stress oxydatif, une dysfonction endothéliale et une diminution de la perfusion musculaire, pouvant affecter la performance et la récupération (59).
3.2.4. Rôle dans la fonction musculaire.
Des concentrations sanguines élevées de folates sont associées à une stimulation de la myogenèse (formation du muscle squelettique), à une amélioration de la force musculaire et à une augmentation du flux sanguin musculaire, ce qui favorise à la fois la performance physique et la régénération du tissu musculaire après l’exercice (62,65).
Ces effets s’expliquent par le rôle central des folates dans la prolifération cellulaire, la différenciation des myoblastes et la synthèse des nucléotides nécessaires à la croissance et à la réparation du tissu musculaire (62,65).
3.2.5. Rôle dans la neurotransmission et la performance cognitive du sportif.
Les folates sont indispensables à la synthèse des neurotransmetteurs tels que la dopamine, la sérotonine et la noradrénaline via les cycles de méthylation et la régénération de la tétrahydrobioptérine (BH4). Ces neurotransmetteurs sont essentiels à la motivation, à la concentration, à la prise de décision et au traitement de l’information, toutes des fonctions clés dans la performance sportive (4,66).
3.2.6. Risque accru de carence chez les sportifs.
Plusieurs études montrent que les athlètes, en particulier les femmes, présentent un risque accru de carence en folates, en raison d’apports alimentaires parfois insuffisants, de pertes accrues et d’une augmentation des besoins métaboliques liée à l’entraînement intensif (61,64).
Une carence sévère en folates provoque une anémie mégaloblastique, réduisant la capacité de transport de l’oxygène, ce qui entraîne une diminution de l’endurance et des performances physiques (61,64).
3.2.7- Intérêt de choisir QuatreFolic®
Dans le contexte sportif, la supplémentation en Quatrefolic®, forme active du folate, favorise la reméthylation de l’homocystéine et améliore la disponibilité des folates intracellulaires, soutenant ainsi la fonction vasculaire, la récupération musculaire, la fonction cognitive et la performance chez les sportifs, en particulier ceux porteurs de polymorphismes MTHFR.
3.3- Santé femme: grossesse, lactation, fertilité et ménopause.
La vitamine B9 joue un rôle central dans la santé reproductive et hormonale féminine tout au long de la vie. Ils interviennent dans la synthèse de l’ADN, la division cellulaire, les processus de méthylation, la protection génomique et le métabolisme de l’homocystéine, ce qui explique leur importance particulière pendant la grossesse, la lactation, la fertilité et la ménopause.
3.3.1- Rôle dans la grossesse
Rôle biologique
La fermeture du tube neural de l’embryon a lieu très précocement, entre le 21ᵉ et le 28ᵉ jour après la conception, souvent avant même que la grossesse ne soit diagnostiquée. Les folates sont indispensables à cette étape critique, car ils fournissent les unités monocarbonées nécessaires à la synthèse de l’ADN, aux réactions de méthylation et à la régulation de l’expression génique, processus qui gouvernent la prolifération, la différenciation et la migration des cellules neuroépithéliales.
Une insuffisance en folates perturbe ces mécanismes fondamentaux, entraînant une altération de la prolifération et de la différenciation des cellules du tube neural, ce qui augmente le risque de défauts de fermeture du tube neural, tels que le spina bifida et l’anencéphalie. Il est bien établi que les femmes ayant des nouveau-nés atteints d’anomalies du tube neural (ATN) présentent fréquemment des concentrations basses de folates sériques et érythrocytaires, même lorsque leurs apports alimentaires semblent adéquats.
La supplémentation en folates pendant la période préconceptionnelle et le premier trimestre de grossesse permet de réduire le risque de défauts du tube neural de 50 à 70 %. L’efficacité et la sécurité de la supplémentation en acide folique dans la prévention des ATN sont solidement démontrées, ce qui a conduit à des recommandations internationales visant à instaurer une supplémentation avant la conception et en début de grossesse afin de réduire le risque de malformations du tube neural (67,68).
Par ailleurs, une supplémentation en folates peut être nécessaire tout au long de la grossesse pour maintenir des concentrations adéquates, car une carence maternelle est associée à un accouchement prématuré, un retard de croissance intra-utérin, un faible poids de naissance et d’autres complications obstétricales (67,68).
Des études montrent que le 5-MTHF est la principale forme de folate présente dans le plasma maternel et dans le sang du cordon ombilical, et qu’il reflète directement l’exposition fœtale aux folates. Les concentrations de 5-MTHF dans le sang du cordon sont fortement corrélées aux taux maternels et sont élevées indépendamment de la race, soulignant que cette forme active est celle effectivement transférée au fœtus (69,70).
Comme l’acide folique doit être converti en 5-MTHF par des enzymes parfois limitées chez de nombreuses personnes, notamment en cas de polymorphisme MTHFR, son efficacité biologique peut être réduite. L’apport direct de 5-MTHF (Quatrefolic®) permet donc d’augmenter plus efficacement les niveaux de folates actifs dans la circulation materno-fœtale, assurant une biodisponibilité optimale pour la grossesse (70).
Folates et preeclampsia
La prééclampsie est une pathologie multifactorielle complexe de la grossesse, définie par une hypertension nouvelle survenant après la 20ᵉ semaine, souvent accompagnée de signes de lésions d’organes tels que des anomalies rénales ou hépatiques.
Des études génétiques ont mis en évidence que le polymorphisme MTHFR C677T, qui diminue l’activité enzymatique de la méthylènetétrahydrofolate réductase, est associé à un risque accru de prééclampsie, notamment dans les populations caucasiennes et d’Asie de l’Est selon une méta-analyse de grande ampleur (71).
Cette association suggère que des altérations du métabolisme des folates et de l’homocystéine peuvent contribuer à la pathogénie de cette complication, et renforce l’intérêt d’assurer des niveaux adéquats de folates biologiquement actifs par une supplémentation en 5-methylfolate chez les femmes enceintes, indépendamment de leur génotype.
Études cliniques de Quatrefolic® chez les femmes enceintes
Le Quatrefolic®, qui correspond à la forme biologiquement active du folate 5-MTHF, présente des caractéristiques pharmacocinétiques et cliniques particulièrement pertinentes pendant la grossesse.
Contrairement à l’acide folique synthétique, il est directement biodisponible et ne dépend pas de l’activité de l’enzyme MTHFR pour être converti en forme active. Dans une étude chez des femmes déjà enceintes,ils ont comparé l’administration de 400 µg de Quatrefolic® à 400 µg d’acide folique chez 40 femmes enceintes et ont montré que le 5-MTHF augmentait plus efficacement les concentrations de folates non seulement dans le sang maternel, mais aussi dans le sang du cordon ombilical, indiquant un meilleur transfert placentaire et un apport fœtal optimisé, y compris chez les femmes présentant des polymorphismes de MTHFR (69).
Par ailleurs, plusieurs études portant sur l’homocystéine ont montré que le 5-MTHF permet de réduire plus rapidement et plus efficacement son taux que l’acide folique chez les femmes enceintes à risque, un point cliniquement important puisque l’hyperhomocystéinémie est associée à la prééclampsie, au décollement placentaire et au faible poids de naissance (72).
Un avantage majeur du 5-MTHF est l’absence de formation d’UMFA, contrairement à l’acide folique synthétique, dont l’accumulation dans le plasma maternel et fœtal pendant la grossesse a été largement documentée et soulève des préoccupations quant à ses effets biologiques potentiels (73).
3.3.2- Rôle dans la dépression post-partum.
Les folates sont également impliqués dans la synthèse des neurotransmetteurs (sérotonine, dopamine, noradrénaline) via leur rôle dans le métabolisme du carbone-un et la régénération du cofacteur BH4, essentiel aux hydroxylases neuronales (74).
Une grande étude de cohorte menée en Chine sur 1 592 femmes a montré qu’une supplémentation en acide folique pendant plus de 6 mois durant la grossesse était associée à une réduction significative du risque de dépression post-partum. Les femmes supplémentées plus longtemps présentaient un risque significativement plus faible de PPD que celles ayant reçu une supplémentation plus courte (75).
Ce lien est biologiquement plausible, car un déficit en folates favorise l’hyperhomocystéinémie, l’hypométhylation cérébrale et une altération de la synthèse des monoamines, tous impliqués dans la physiopathologie des troubles dépressifs (59,76).
3.3.3- Rôle dans la lactation.
Pendant l’allaitement, les besoins en folates augmentent en raison du transfert actif de folates vers le lait maternel. Le lait humain contient des concentrations élevées de 5-méthyltétrahydrofolate, qui est la principale forme circulante de folate chez le nourrisson, essentielle à la croissance, à l’hématopoïèse et au développement neurologique du nouveau-né (4,77).
L’EFSA estime que la perte moyenne de folates via le lait maternel est d’environ 130 µg DFE/jour, ce qui justifie une augmentation des apports chez la femme allaitante. En tenant compte de cette perte, le besoin nutritionnel moyen (BNM) est fixé à 380 µg DFE/jour, et la référence nutritionnelle pour la population (RNP) à 500 µg DFE/jour chez la femme allaitante (4).
Une insuffisance en folates pendant la lactation peut entraîner une diminution de la concentration en folates du lait maternel, une déplétion progressive des réserves maternelles, et, chez le nourrisson, un risque accru d’anémie mégaloblastique et de retard de croissance (4,77).
Chez les femmes porteuses du polymorphisme MTHFR C677T, la capacité à convertir l’acide folique en 5-MTHF est réduite. L’apport direct de 5-MTHF (par exemple sous forme de Quatrefolic®) permet de garantir la disponibilité de la forme biologiquement active du folate pour la mère et pour le nourrisson via le lait maternel, indépendamment de l’efficacité enzymatique (4).
3.3.4- Rôle dans la fertilité.
La fertilité humaine dépend étroitement du métabolisme des folates, qui intervient dans la synthèse de l’ADN, la méthylation épigénétique et la régulation de l’homocystéine. Ces mécanismes conditionnent la qualité des gamètes, le développement embryonnaire précoce et l’implantation (78,79). Une carence fonctionnelle en folates, même modérée, conduit à une hypométhylation, à des erreurs de réplication et à une instabilité génomique, qui se traduisent par une baisse de la fertilité et une augmentation du risque de fausses couches (78–80).
Chez la femme, une insuffisance en folates altère la maturation ovocytaire, la stabilité chromosomique et la réceptivité endométriale. L’élévation de l’homocystéine, conséquence d’un déficit fonctionnel en folates, est associée à une augmentation des échecs d’implantation et des fausses couches (79–81). Chez l’homme, le folate est indispensable à la spermatogenèse. Des taux bas sont liés à une diminution de la concentration spermatique, à des anomalies morphologiques et à une augmentation de la fragmentation de l’ADN des spermatozoïdes, réduisant la fertilité et la viabilité embryonnaire (51,82,83).
Le polymorphisme MTHFR C677T réduit la conversion des folates et de l’acide folique en 5-MTHF, entraînant une carence fonctionnelle intracellulaire et une hyperhomocystéinémie, même en cas d’apports alimentaires normaux. Ce polymorphisme est associé aux troubles de la fertilité et aux échecs répétés de PMA (78,84). Chez des couples infertiles porteurs de polymorphismes de MTHFR, la supplémentation en 5-MTHF a permis de réduire significativement les concentrations d’homocystéine et de normaliser le métabolisme des folates vers un profil compatible avec la fertilité (85).
Études cliniques de Quatrefolic® dans les troubles de la fertilité
Des études observationnelles ont évalué l’utilisation du Quatrefolic® chez des couples présentant des troubles de la fertilité associés à des polymorphismes du gène MTHFR et à des échecs sous acide folique. Dans une première série de cas (86), sept couples présentant des antécédents de fausses couches répétées ont été suivis après supplémentation en Quatrefolic®; une conception est survenue chez six couples sur sept.
Dans une autre série de cas, incluant 33 couples infertiles depuis au moins quatre ans, fréquemment après échec de la procréation médicalement assistée, une conception a été rapportée chez 30 couples, 13 dans le cadre de cycles spontanés et 17 après recours à la PMA (87). Les auteurs concluent que le 5-MTHF permet de contourner le bloc métabolique lié aux variants du gène MTHFR et qu’il est associé à une amélioration significative des issues reproductives dans ces populations à haut risque.
3.3.5- Rôle dans la ménopause
Après la ménopause, le risque cardiovasculaire et le déclin cognitif augmentent, en partie en raison d’une élévation de l’homocystéine, d’une diminution de l’efficacité des réactions de méthylation et d’une expression fonctionnelle plus marquée des polymorphismes du gène MTHFR, notamment C677T. Cette combinaison favorise une carence intracellulaire en 5-méthyltétrahydrofolate (5-MTHF) même lorsque les apports en folates sont adéquats, ce qui altère la fonction endothéliale, le métabolisme neuronal et la régulation épigénétique (35,59).
Plusieurs travaux ont montré que l’hyperhomocystéinémie post-ménopausique contribue à l’augmentation du risque cardiovasculaire, au dysfonctionnement endothélial et au déclin cognitif, en particulier chez les femmes porteuses du polymorphisme MTHFR 677TT (31,88).
Des études d’intervention indiquent que la supplémentation en 5-MTHF permet de réduire efficacement l’homocystéine plasmatique et d’améliorer le statut folique fonctionnel chez les femmes porteuses du polymorphisme C677T, en contournant l’étape enzymatique limitante de la MTHFR (89,90).
Cependant, les données disponibles ne montrent pas encore de bénéfice clinique net chez l’ensemble des femmes ménopausées. En revanche, chez les femmes ménopausées présentant le génotype MTHFR 677TT ou CT, le 5-MTHF apparaît comme un adjuvant biologiquement pertinent pour restaurer les capacités de méthylation et réduire l’hyperhomocystéinémie, ce qui pourrait contribuer à la prévention cardiovasculaire et neurovasculaire (4,31).
3.3.6- Intérêt de choisir QuatreFolic®.
Les données cliniques et génétiques montrent que, chez la femme, l’efficacité réelle d’une supplémentation en folates dépend avant tout de la capacité à fournir du 5-MTHF, la seule forme biologiquement active utilisable par les tissus, le placenta, le cerveau et les cellules germinales. Le 5-MTHF est la forme prédominante mesurée dans le plasma maternel et dans le sang du cordon, et reflète directement l’exposition fœtale aux folates, indépendamment de l’origine ethnique(4,69,70). Or, une proportion importante de femmes présente une capacité réduite à convertir l’acide folique en 5-MTHF en raison du polymorphisme MTHFR C677T, ce qui est associé à une hyperhomocystéinémie et à un risque accru de complications telles que troubles de la fertilité, prééclampsie, fausses couches, troubles de l’humeur post-partum et risque cardiovasculaire.
L’apport direct de 5-MTHF sous forme de Quatrefolic® permet de contourner cette limitation enzymatique et d’assurer, à toutes les phases de la vie féminine, des niveaux adéquats de folates biologiquement actifs là où ils sont nécessaires, garantissant une efficacité métabolique plus fiable que l’acide folique classique.
4.Posologie
Dosage : 400 µg/jour de Quatrefolic®.
5. Contre-indications
-Méthotrexate, Pemetrexed, autres antifolates (anticancéreux) : Quatrefolic® étant déjà actif, pourrait réduire l’efficacité du médicament. Surveillance recommandée.
-Sulfadoxine-pyriméthamine (antipaludique) : Folate actif peut favoriser la survie du parasite malgré l’inhibition de la synthèse folique.
-Phénytoïne, Carbamazépine (antiépileptiques) : Folate actif peut accélérer le métabolisme hépatique du médicament, nécessitant un suivi thérapeutique.
-Autres médicaments DHFR-inhibiteurs : Risque potentiel similaire à celui des antifolates. Surveillance recommandée.
6. Conclusion
Quatrefolic® apporte le folate directement sous sa forme biologiquement active (5-MTHF), garantissant une biodisponibilité élevée, indépendante des polymorphismes MTHFR. Sa formulation standardisée assure un apport précis, reproductible et conforme aux équivalents folates alimentaires (EFA) définis par l’EFSA. Contrairement à l’acide folique, il ne génère pas d’UMFA et présente un meilleur profil de sécurité, notamment pendant la grossesse.
Cette forme active soutient la fertilité, la grossesse et la lactation en optimisant le statut en folates et l’apport fœto-maternel. Elle contribue également, dans les situations de forte demande métabolique comme l’activité sportive, à une érythropoïèse efficace, au métabolisme énergétique et à la récupération musculaire. Quatrefolic® constitue ainsi une source de folate métaboliquement efficace, sûre et adaptée aux états de besoins accrus.
Blakley R. The Biochemistry of Folic Acid and Related Pteridines. Ann Intern Med.1970;72(1):153‑153.
Bailey LB (Ed. ). Folate in Health and Disease. 2e éd. CRC Press; 2010.
Ciqual 2020. ANSES. Table de composition nutritionnelle des aliments –. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES). 2020; Disponible sur: https://ciqual.anses.fr/
EFSA Panel on Nutrition, Novel Foods and Food Allergens (NDA Panel), Turck D, Bohn T, Castenmiller J, de Henauw S, Hirsch‐Ernst K, et al. Scientific opinion on the tolerable upper intake level for folate. EFSA J. nov 2023;21(11). Disponible sur: https://data.europa.eu/doi/10.2903/j.efsa.2023.8353
Patring JDM, Jastrebova JA, Hjortmo SB, Andlid TA, Jägerstad IM. Development of a Simplified Method for the Determination of Folates in Baker’s Yeast by HPLC with Ultraviolet and Fluorescence Detection. J Agric Food Chem. 2005;53(7):2406‑11.
Scott J, Weir D. Folate/vitamin B12 inter-relationships. Essays Biochem. 1994;28:63‑72.
Delchier N, Ringling C, Cuvelier ME, Courtois F, Rychlik M, Renard CMGC. Thermal degradation of folates under varying oxygen conditions. Food Chem. 2014;165:85‑91.
Gregory JF. Case Study: Folate Bioavailability. J Nutr. 2001;131(4):1376S-1382S.
Obeid R, Kirsch SH, Kasoha M, Eckert R, Herrmann W. Concentrations of unmetabolized folic acid and primary folate forms in plasma after folic acid treatment in older adults. Metabolism. 2011;60(5):673‑80.
ANSES. Publication des nouvelles références nutritionnelles en vitamines et minéraux pour la population française | Anses - Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail [Internet]. 2021 [cité 12 janv 2026]. Disponible sur: https://www.anses.fr/fr/content/publication-des-nouvelles-references-nutritionnelles-en-vitamines-et-mineraux-pour-la?utm_source=chatgpt.com
Viswanathan M, Urrutia RP, Hudson KN, Middleton JC, Kahwati LC. Folic Acid Supplementation to Prevent Neural Tube Defects: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2023;330(5):460.
Bailey LB, Stover PJ, McNulty H, Fenech MF, Gregory JF, Mills JL, et al. Biomarkers of Nutrition for Development—Folate Review. J Nutr. 2015;145(7):1636S-1680S.
Carmel R. Folate Deficiency. In: Carmel R, Jacobsen DW, éditeurs. Homocysteine in Health and Disease. Cambridge, UK: Cambridge University Press; 2001. p. 271‑88.
Herbert V. Experimental nutritional folate deficiency in man. Trans Assoc Am Physicians. 1962;75:307‑20.
Lindenbaum J, Allen RH. Clinical spectrum and diagnosis of folate deficiency. Folate Health Dis. 1995;1:43‑73.
Daly LE. Folate Levels and Neural Tube Defects: Implications for Prevention. JAMA. 1995;274(21):1698.
Butterworth CE, Tamura T. Folic acid safety and toxicity: a brief review. Am J Clin Nutr. 1989;50(2):353‑8.
Kano Y, Sakamoto S, Hida K, Suda K, Takaku F. 5-Methyltetrahydrofolate related enzymes and DNA polymerase alpha activities in bone marrow cells from patients with vitamin B12 deficient megaloblastic anemia. Blood.1982;59(4):832‑7.
Green T. Discussion: Indicators for Assessing Folate and Vitamin B12 Status and for Monitoring the Efficacy of Intervention Strategies. Food Nutr Bull. 2008;29(2_suppl1):S64‑6.
Lamers Y, Prinz-Langenohl R, Brämswig S, Pietrzik K. Red blood cell folate concentrations increase more after supplementation with [6 S]-5-methyltetrahydrofolate than with folic acid in women of childbearing age. Am J Clin Nutr. 2006;84(1):156‑61.
Gregory Iii JF, Quinlivan EP. I N V IVO K INETICS OF F OLATE M ETABOLISM. Annu Rev Nutr. 2002;22(1):199‑220.
IOM. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride [Internet]. Washington, D.C.: National Academies Press; 1997. Disponible sur: https://www.nationalacademies.org/publications/5776
De Benoist B. Conclusions of a WHO Technical Consultation on Folate and Vitamin B12 Deficiencies. Food Nutr Bull. 2008;29(2_suppl1):S238‑44.
Wu A, Chanarin I, Slavin G, Levi AJ. Folate Deficiency in the Alcoholic—its Relationship to Clinical and Haematological Abnormalities, Liver Disease and Folate Stores. Br J Haematol. 1975;29(3):469‑78.
Herbert V. The 1986 Herman award lecture. Nutrition science as a continually unfolding story: the folate and vitamin B-12 paradigm. Am J Clin Nutr. 1987;46(3):387‑402.
Eichner ER, Hillman RS. Effect of Alcohol on Serum Folate Level. J Clin Invest. 1973;52(3):584‑91.
Duffy ME, Hoey L, Hughes CF, Strain J, Rankin A, Souverein OW, et al. Biomarker responses to folic acid intervention in healthy adults: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2014;99(1):96‑106.
Selhub J. Folate, vitamin B12 and vitamin B6 and one carbon metabolism. J Nutr Health Aging. 2002;6(1):39‑42.
Tighe P, Ward M, McNulty H, Finnegan O, Dunne A, Strain J, et al. A dose-finding trial of the effect of long-term folic acid intervention: implications for food fortification policy. Am J Clin Nutr. 2011;93(1):11‑8.
Green R, Miller JW. Vitamin B12 deficiency is the dominant nutritional cause of hyperhomocysteinemia in a folic acid-fortified population. Clin Chem Lab Med CCLM. 2005;43(10).
McNulty H, Scott JM. Intake and status of folate and related B-vitamins: considerations and challenges in achieving optimal status. Br J Nutr. 2008;99(S3):S48‑54
Christensen K, Rozen R. Genetic variation: Effect on folate metabolism and health. Folate Health Dis. 2010;75‑110.
Hiraoka M, Kagawa Y. Genetic polymorphisms and folate status. Congenit Anom. 2017;57(5):142‑9.
Hustad S, Midttun Ø, Schneede J, Vollset SE, Grotmol T, Ueland PM. The Methylenetetrahydrofolate Reductase 677C→T Polymorphism as a Modulator of a B Vitamin Network with Major Effects on Homocysteine Metabolism. Am J Hum Genet. 2007;80(5):846‑55.
Davis SR, Quinlivan EP, Shelnutt KP, Ghandour H, Capdevila A, Coats BS, et al. Homocysteine Synthesis Is Elevated but Total Remethylation Is Unchanged by the Methylenetetrahydrofolate Reductase 677C→T Polymorphism and by Dietary Folate Restriction in Young Women. J Nutr.2005;135(5):1045‑50.
Jacques PF, Bostom AG, Williams RR, Ellison RC, Eckfeldt JH, Rosenberg IH, et al. Relation Between Folate Status, a Common Mutation in Methylenetetrahydrofolate Reductase, and Plasma Homocysteine Concentrations. Circulation. 1996;93(1):7‑9.
Yan L, Zhao L, Long Y, Zou P, Ji G, Gu A, et al. Association of the Maternal MTHFR C677T Polymorphism with Susceptibility to Neural Tube Defects in Offsprings: Evidence from 25 Case-Control Studies. Xiong M, éditeur. PLoS ONE.2012;7(10):e41689.
Mtiraoui N, Zammiti W, Ghazouani L, Braham NJ, Saidi S, Finan RR, et al. Methylenetetrahydrofolate reductase C677T and A1298C polymorphism and changes in homocysteine concentrations in women with idiopathic recurrent pregnancy losses. Reproduction.2006;131(2):395‑401.
Hankey G, Eikelboom J. Homocysteine and stroke. The Lancet. 2005;365(9455):194‑6.
Lewis SJ, Zammit S, Gunnell D, Smith GD. A meta‐analysis of the MTHFR C677T polymorphism and schizophrenia risk. Am J Med Genet B Neuropsychiatr Genet. 2005;135B(1):2‑4.
Gilbody S, Lewis S, Lightfoot T. Methylenetetrahydrofolate Reductase (MTHFR) Genetic Polymorphisms and Psychiatric Disorders: A HuGE Review. Am J Epidemiol. 2006;165(1):1‑13.
Carboni L. Active Folate Versus Folic Acid: The Role of 5-MTHF (Methylfolate) in Human Health. Integr Med. 2022;21(3):36‑41.
Dajani R, Fathallah R, Arafat A, AbdulQader ME, Hakooz N, Al-Motassem Y, et al. Prevalence of MTHFR C677T Single Nucleotide Polymorphism in Genetically Isolated Populations in Jordan. Biochem Genet.2013;51(9‑10):780‑8.
Yadav U, Kumar P, Gupta S, Rai V. Distribution of MTHFR C677T Gene Polymorphism in Healthy North Indian Population and an Updated Meta-analysis. Indian J Clin Biochem IJCB. 2017;32(4):399‑410.
Guéant-Rodriguez RM, Guéant JL, Debard R, Thirion S, Hong LX, Bronowicki JP, et al. Prevalence of methylenetetrahydrofolate reductase 677T and 1298C alleles and folate status: a comparative study in Mexican, West African, and European populations. Am J Clin Nutr. 2006;83(3):701‑7.
Ashfield-Watt PA, Pullin CH, Whiting JM, Clark ZE, Moat SJ, Newcombe RG, et al. Methylenetetrahydrofolate reductase 677C→T genotype modulates homocysteine responses to a folate-rich diet or a low-dose folic acid supplement: a randomized controlled trial,,. Am J Clin Nutr. 2002;76(1):180‑6.
Bailey LB. Folate in health and disease, second edition. Folate in Health and Disease, Second Edition. 2009. 1 p.
Guyader ML, Garçon L. Les vitamines B9 et B12 : rôle métabolique, étiologies et conséquences des carences, méthodes d’exploration et recommandations nutritionnelles. Rev Francoph Lab. 2019;2019(514):55‑64.
Blom HJ, Shaw GM, Den Heijer M, Finnell RH. Neural tube defects and folate: case far from closed. Nat Rev Neurosci. 2006;7(9):724‑31.
Araújo JR, Martel F, Borges N, Araújo JM, Keating E. Folates and aging: Role in mild cognitive impairment, dementia and depression. Ageing Res Rev. 2015;22:9‑19.
D’Elia S, Morello M, Titolo G, Caso VM, Solimene A, Luisi E, et al. Homocysteine in the Cardiovascular Setting: What to Know, What to Do, and What Not to Do. J Cardiovasc Dev Dis. 2025;12(10):383.
Essouma M, Noubiap JJN. Therapeutic potential of folic acid supplementation for cardiovascular disease prevention through homocysteine lowering and blockade in rheumatoid arthritis patients. Biomark Res. 2015;3(1):24.
Handy DE, Loscalzo J. Homocysteine and atherothrombosis: Diagnosis and treatment. Curr Atheroscler Rep. 2003;5(4):276‑83.
Antoniades C, Shirodaria C, Warrick N, Cai S, De Bono J, Lee J, et al. 5-Methyltetrahydrofolate Rapidly Improves Endothelial Function and Decreases Superoxide Production in Human Vessels: Effects on Vascular Tetrahydrobiopterin Availability and Endothelial Nitric Oxide Synthase Coupling. Circulation. 2006;114(11):1193‑201.
Coppola A, D’Angelo A, Fermo I, Mazzola G, Minno MNDD, Cajani A, et al. Reduced in vivo oxidative stress following 5‐methyltetrahydrofolate supplementation in patients with early‐onset thrombosis and 677TT methylenetetrahydrofolate reductase genotype. Br J Haematol. 2005;131(1):100‑8.
Willems FF, Boers GHJ, Blom HJ, Aengevaeren WRM, Verheugt FWA. Pharmacokinetic study on the utilisation of 5‐methyltetrahydrofolate and folic acid in patients with coronary artery disease. Br J Pharmacol. 2004;141(5):825‑30.
Patterson S, Flatt PR, Brennan L, Newsholme P, McClenaghan NH. Detrimental actions of metabolic syndrome risk factor, homocysteine, on pancreatic β-cell glucose metabolism and insulin secretion. J Endocrinol. 2006;189(2):301‑10.
Lind MV, Lauritzen L, Kristensen M, Ross AB, Eriksen JN. Effect of folate supplementation on insulin sensitivity and type 2 diabetes: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2019;109(1):29‑42.
Selhub J. HOMOCYSTEINE METABOLISM. Annu Rev Nutr.1999;19(1):217‑46.
Fenech M. The role of folic acid and Vitamin B12 in genomic stability of human cells. Mutat Res - Fundam Mol Mech Mutagen.2001;475(1‑2):57‑67.
Novack V, Finestone AS, Constantini N, Shpilberg O, Weitzman S, Merkel D. The prevalence of low hemoglobin values among new infantry recruits and nonlinear relationship between hemoglobin concentration and physical fitness. Am J Hematol.2007;82(2):128‑33.
Hwang SY, Sung B, Kim ND. Roles of folate in skeletal muscle cell development and functions. Arch Pharm Res. 2019;42(4):319‑25.
Veeranki S, Tyagi S. Defective Homocysteine Metabolism: Potential Implications for Skeletal Muscle Malfunction. Int J Mol Sci. 2013;14(7):15074‑91.
Mairbäurl H. Red blood cells in sports: effects of exercise and training on oxygen supply by red blood cells. Front Physiol. 2013;4.
Stanhewicz AE, Kenney WL. Role of folic acid in nitric oxide bioavailability and vascular endothelial function. Nutr Rev. 2017;75(1):61‑70.
Frye. Central tetrahydrobiopterin concentration in neurodevelopmental disorders. Front Neurosci. 2010.
De-Regil LM, Fernández-Gaxiola AC, Dowswell T, Peña-Rosas JP. Effects and safety of periconceptional folate supplementation for preventing birth defects. In: The Cochrane Collaboration, éditeur. Cochrane Database of Systematic Reviews [Internet]. Chichester, UK: John Wiley & Sons, Ltd; 2010 [cité 4 févr 2026]. p. CD007950.pub2. Disponible sur: https://doi.wiley.com/10.1002/14651858.CD007950.pub2
Czeizel AE, Dudás I. Prevention of the First Occurrence of Neural-Tube Defects by Periconceptional Vitamin Supplementation. N Engl J Med. 1992;327(26):1832‑5.
Maulik D, Van Haandel L, Allsworth J, Chaisanguanthum KS, Yeast JD, Leeder JS. The effect of race and supplementation on maternal and umbilical cord plasma folates. J Matern Fetal Neonatal Med. 2021;34(18):3057‑65.
Obeid R, Holzgreve W, Pietrzik K. Is 5-methyltetrahydrofolate an alternative to folic acid for the prevention of neural tube defects? jpme.2013;41(5):469‑83.
Li X, Luo YL, Zhang QH, Mao C, Wang XW, Liu S, et al. Methylenetetrahydrofolate reductase gene C677T, A1298C polymorphisms and pre-eclampsia risk: a meta-analysis. Mol Biol Rep. 2014;41(8):5435‑48.
Yajnik CS, Chandak GR, Joglekar C, Katre P, Bhat DS, Singh SN, et al. Maternal homocysteine in pregnancy and offspring birthweight: epidemiological associations and Mendelian randomization analysis. Int J Epidemiol. 2014;43(5):1487‑97.
Plumptre L, Masih SP, Ly A, Aufreiter S, Sohn KJ, Croxford R, et al. High concentrations of folate and unmetabolized folic acid in a cohort of pregnant Canadian women and umbilical cord blood. Am J Clin Nutr. 2015;102(4):848‑57.
Shane B. Folate and Vitamin B12 Metabolism: Overview and Interaction with Riboflavin, Vitamin B6 , and Polymorphisms. Food Nutr Bull. 2008;29(2_suppl1):S5‑16.
Yan J, Liu Y, Cao L, Zheng Y, Li W, Huang G. Association between Duration of Folic Acid Supplementation during Pregnancy and Risk of Postpartum Depression. Nutrients.2017;9(11):1206.
Bottiglieri T, Hyland K, Laundy M, Godfrey P, Carney MWP, Toone BK, et al. Folate deficiency, biopterin and monoamine metabolism in depression. Psychol Med.1992;22(4):871‑6.
Tamura T, Picciano MF. Folate and human reproduction. Am J Clin Nutr.2006;83(5):993‑1016.
Laanpere M, Altmäe S, Stavreus-Evers A, Nilsson TK, Yngve A, Salumets A. Folate-mediated one-carbon metabolism and its effect on female fertility and pregnancy viability. Nutr Rev. 2010;68(2):99‑113.
Forges T, Pellanda H, Diligent C, Monnier P, Guéant JL. Les folates : quel impact sur la fertilité ? Gynécologie Obstétrique Fertil. 2008;36(9):930‑9.
Gaskins AJ, Rich-Edwards JW, Hauser R, Williams PL, Gillman MW, Ginsburg ES, et al. Maternal Prepregnancy Folate Intake and Risk of Spontaneous Abortion and Stillbirth. Obstet Gynecol. 2014;124(1):23‑31.
D’Uva M, Di Micco P, Strina I, Alviggi C, Iannuzzo M, Ranieri A, et al. Hyperhomocysteinemia in women with unexplained sterility or recurrent early pregnancy loss from Southern Italy: a preliminary report. Thromb J. 2007;5:10.
Gong M, Dong W, He T, Shi Z, Huang G, Ren R, et al. MTHFR 677C>T Polymorphism Increases the Male Infertility Risk: A Meta-Analysis Involving 26 Studies. Ward WS, éditeur. PLOS ONE. 2015;10(3):e0121147.
Lambrot R, Xu C, Saint-Phar S, Chountalos G, Cohen T, Paquet M, et al. Low paternal dietary folate alters the mouse sperm epigenome and is associated with negative pregnancy outcomes. Nat Commun. 2013;4(1):2889.
Menezo Y, Clement P, Dale B, Elder K. Modulating oxidative stress and epigenetic homeostasis in preimplantation IVF embryos. Zygote. 2022;30(2):149‑58.
Clément A, Menezo Y, Cohen M, Cornet D, Clément P. 5-Methyltetrahydrofolate reduces blood homocysteine level significantly in C677T methyltetrahydrofolate reductase single-nucleotide polymorphism carriers consulting for infertility. J Gynecol Obstet Hum Reprod. 2020;49(1):101622.
Servy E, Menezo Y. The Methylene Tetrahydrofolate Reductase (MTHFR) isoform challenge. High doses of folic acid are not a suitable option compared to 5 Methyltetrahydrofolate treatment. Clin Obstet Gynecol Reprod Med. 2017;3(6).
Servy EJ, Jacquesson-Fournols L, Cohen M, Menezo YJR. MTHFR isoform carriers. 5-MTHF (5-methyl tetrahydrofolate) vs folic acid: a key to pregnancy outcome: a case series. J Assist Reprod Genet. 2018;35(8):1431‑5.
Lambrinoudaki I, Papadimitriou D, Kaparos G, Rizos D, Panoulis C, Deligeoroglou E, et al. MTHFR C677T polymorphism modifies the effect of HRT on metabolic parameters in postmenopausal women. Climacteric. 2013;16(5):568‑75.
Lamers Y, Prinz-Langenohl R, Moser R, Pietrzik K. Supplementation with [6S]-5-methyltetrahydrofolate or folic acid equally reduces plasma total homocysteine concentrations in healthy women. Am J Clin Nutr. 2004;79(3):473‑8.
Litynski P, Loehrer F, Linder L, Todesco L, Fowler B. Effect of low doses of 5‐methyltetrahydrofolate and folic acid on plasma homocysteine in healthy subjects with or without the 677C→T polymorphism of methylenetetrahydrofolate reductase. Eur J Clin Invest. 2002;32(9):662‑8.
Autrices:
Myriam POUSSE (Docteure en Pharmacie, Directrice Scientifique)
Reyes RODENAS (Docteure en Pharmacie, Chercheuse Scientifique)
Date: 05/02/2026