Pure Sommeil
Le stress, l’anxiété, le jet-lag, les écrans sont les causes principales à l’origine des troubles du sommeil.
Ces troubles se matérialisent par des difficultés à s’endormir, des insomnies ou dans une moindre mesure un sommeil agité. Cela entraîne une fatigue chronique qui engendre des difficultés au quotidien.
Pourtant dormir est essentiel pour vivre sereinement, rester en bonne santé et récupérer de sa journée.
Pure Sommeil est une solution pour tous ceux qui ont du mal à s’endormir ou qui travaillent de nuit et ont besoin d’un coup de pouce pour trouver le sommeil en pleine journée.
Composé de mélatonine et de plantes, il va vous aider à retrouver un sommeil de bébé (qui fait ses nuits bien entendu) ;)
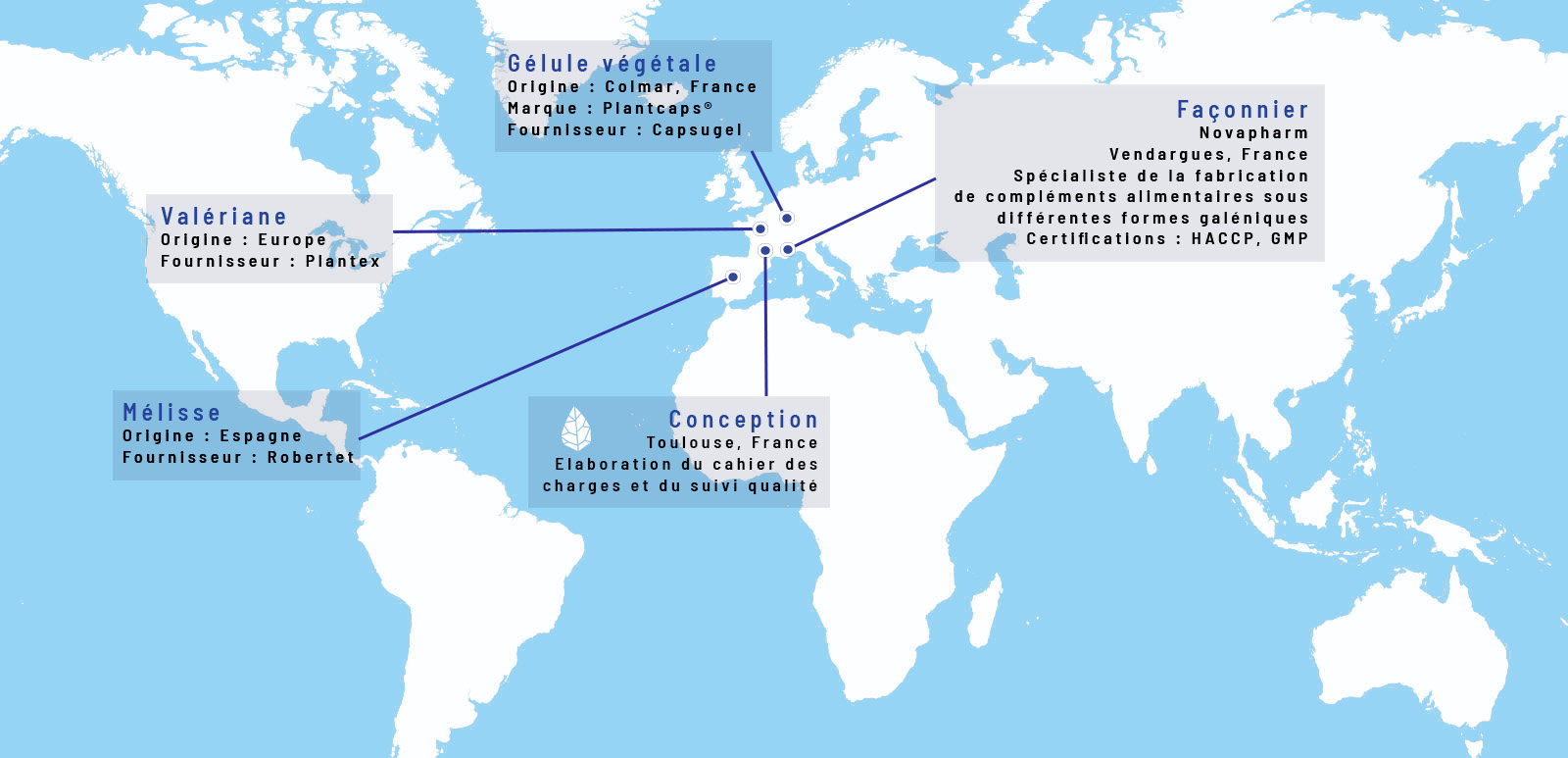
- La valériane, la mélisse, le coquelicot et l’aubépine contribuent à une relaxation optimale
- La mélisse contribue au bien-être physique et mental, ainsi qu’à une humeur positive et équilibrée
- La valériane aide à retrouver le calme en cas de stress et d’irritabilité
- La mélisse, la valériane et le coquelicot facilitent un sommeil de qualité
- La mélatonine et le coquelicot contribuent à réduire le temps d’endormissement.
- La mélatonine diminue les effets du décalage horaire
- 92% des clients sont satisfaits ou très satisfaits du produit*
- 96% ont senti une facilité à s'endormir*
- 83% ont moins de réveils indésirés*
- 67% ont senti une réduction de leur fatigue*
- 1 SEMAINE en moyenne pour ressentir les effets de Pure Sommeil*
* Étude de satisfaction réalisée auprès d'un panel de clients tirés aléatoirement

LE RÔLE DU SOMMEIL SUR LA SANTÉ
Bien dormir est primordial pour rester en bonne santé.
Aujourd’hui, 1 français sur 3 est concerné par les troubles du sommeil d’après l’Inserm.
L’hygiène de vie, le stress au travail, la charge mentale à la maison, la consommation d’alcool ou de tabac mais aussi l’environnement immédiat (luminosité, écrans) sont en cause.
Un manque de sommeil ou un sommeil agité provoquent une irritabilité, des sautes d’humeur, de la fatigue, une incapacité à se concentrer mais également des troubles plus graves.
En effet, à long terme, un manque de sommeil peut faciliter le développement de maladies plus graves.

LA MÉLATONINE, L'HORMONE DU SOMMEIL
La mélatonine est l’hormone du sommeil. C’est grâce à elle que l’on ressent les premiers signes de l’endormissement, précurseurs d’une bonne nuit de sommeil. Sa production naturelle diminue naturellement avec l’âge.
La prise d’un complément alimentaire pour le sommeil, notamment à base de mélatonine, permet faciliter l'endormissement et de limiter les problèmes de sommeil passagers dans une période de stress.
C’est également une solution pour retrouver un bon rythme circadien après un long voyage le décalage horaire se fait sentir.
Nutripure a fait le choix d'une mélatonine, pour une qualité irréprochable. La posologie répartie sur 2 gélules permet de moduler ses apports en mélatonine et d'éviter d'un apport maximal en mélatonine si ce n'est pas nécessaire.

LES PLANTES AU SERVICE DU SOMMEIL
C’est grâce à la combinaison de la mélatonine avec des plantes apaisantes et relaxantes que vous obtenez l'efficacité de Pure Sommeil.
Pure Sommeil est composé d'extraits de mélisse, de valériane, d’aubépine et de coquelicot. Chaque plante possède des propriétés qui ensemble forment une synergie efficace.
- La mélisse est réputée pour favoriser la relaxation, la bonne humeur, le bien-être physique et maintenir un bon fonctionnement cognitif et un sommeil de qualité.
- La valériane est connue pour son action sur l’anxiété, le stress et les tensions nerveuses. Elle a un rôle relaxant, indispensable pour se calmer avant l’endormissement.
- L’aubépine apaise les tensions et contribue à un sommeil naturel.
- Le coquelicot possède des vertus calmantes et relaxantes. Le coquelicot contribue à un sommeil de qualité.
Ce que dit la science sur la mélatonine
La mélatonine est une hormone naturelle que notre corps produit lui-même, principalement par la glande pinéale située dans notre cerveau. Surnommée à juste titre "l'hormone du sommeil", sa fonction principale est de réguler notre horloge biologique interne, notamment le cycle veille-sommeil, pour le synchroniser avec l'alternance du jour et de la nuit.
Sa production est déclenchée par l'obscurité, avec un pic au milieu de la nuit, puis diminue avec le retour de la lumière. Cependant, ce cycle naturel peut être perturbé par des facteurs modernes comme l'exposition à la lumière bleue des écrans le soir, les voyages ou le travail de nuit. De plus, sa sécrétion tend à diminuer naturellement avec l'âge, ce qui peut influencer la qualité du sommeil.
Un apport en mélatonine sous forme de complément alimentaire est scientifiquement reconnu pour ses bienfaits ciblés. Les autorités de santé européennes ont validé deux allégations principales :
- La mélatonine contribue à réduire le temps d’endormissement (l’effet bénéfique est obtenu par la consommation de 1 mg juste avant le coucher).
- Elle contribue également à atténuer les effets du décalage horaire (l’effet bénéfique est obtenu par la consommation d’au moins 0,5 mg juste avant le coucher le premier jour du voyage et les quelques jours suivant l'arrivée).
La supplémentation constitue ainsi une aide ponctuelle et étudiée pour aider à resynchroniser son rythme interne lorsque celui-ci est décalé.
Pour avoir des références scientifiques complètes cliquez ici
Composition
Extrait sec de Mélisse (Melissa officinalis), extrait sec d’Aubépine (Crataegus laevigata), gélule d’origine végétale (agent d’enrobage : pullulan), extrait sec de Coquelicot (Papaver rhoeas), extrait sec de Valériane (Valeriana officinalis), mélatonine.
Informations Nutritionnelles
| Informations nutritionnelles | Quantité par dose journalière (2 gélules) |
|---|---|
| Extrait de Mélisse Equivalent plante sèche Dont acide rosmarinique |
160 mg 1600 mg 11,2 mg |
| Extrait de Valériane Dont acide valérinique |
120 mg 0,36 mg |
| Extrait de Coquelicot | 152 mg |
| Extrait d’Aubépine | 200 mg |
| Mélatonine | 1,9 mg |
Transparence
Conforme à la norme anti-dopage
 Cette norme, reconnue à l'échelle européenne, est une référence en matière de prévention de produits dopants. Elle garantit la mise en place de bonnes pratiques de développement et de fabrication visant à prévenir la présence de toutes substances interdites. Chez Nutripure, nous nous engageons à offrir à tous nos clients, qu'ils soient sportifs amateurs ou athlètes de haut niveau, une garantie totale de sécurité, de traçabilité et de qualité pour vous offrir des produits sûrs, fiables et efficaces.
Cette norme, reconnue à l'échelle européenne, est une référence en matière de prévention de produits dopants. Elle garantit la mise en place de bonnes pratiques de développement et de fabrication visant à prévenir la présence de toutes substances interdites. Chez Nutripure, nous nous engageons à offrir à tous nos clients, qu'ils soient sportifs amateurs ou athlètes de haut niveau, une garantie totale de sécurité, de traçabilité et de qualité pour vous offrir des produits sûrs, fiables et efficaces. *Ce produit a été développé et fabriqué conformément aux exigences de l'EN 17444 à la date de production du lot.
Avertissements
Les compléments alimentaires doivent être utilisés dans le cadre d’un mode de vie sain et ne pas être utilisés comme substituts d’un régime alimentaire varié et équilibré.
Déconseillé aux enfants, adolescents, femmes enceintes ou allaitantes, ainsi qu'aux personnes souffrant de maladies inflammatoires ou auto-immunes. Demander un avis médical pour les personnes souffrants de troubles de l'humeur, du comportement ou de la personnalité, suivant un traitement médicamenteux ou en cas d'épilepsie et d'asthme.
Ne pas dépasser la dose journalière recommandée. Usage prolongé déconseillé. En raison du risque de somnolence ne pas conduire après la prise des gélules.
Dosage & Préparation
![]() Prendre 1 à 2 gélules avec un verre d’eau 30 minutes avant le coucher.
Prendre 1 à 2 gélules avec un verre d’eau 30 minutes avant le coucher.
- Pour les décalages horaires, une gélule suffit.
- Pour les troubles du sommeil, il est préférable de prendre deux gélules.
Conseils d'utilisation
L’effet bénéfique de la mélatonine est obtenu par la consommation de 1mg avant le coucher.
Une gélule équivaut à 0,95mg de mélatonine.
A conserver dans un endroit frais et à l’abri de la lumière.