Pure Electrolytes
Des éléments indispensables pour l’équilibre de votre organisme
Les électrolytes (Calcium, Potassium, Sodium, Magnésium, Zinc) jouent un rôle vital dans notre corps. Leur présence suffisante est indispensable au bon fonctionnement musculaire, au maintien d’un bon niveau d’hydratation du corps ainsi qu’à l’équilibre acido-basique.
Les électrolytes sont essentiels pour permettre aux fibres musculaires de se contracter et de se détendre, en particulier le sodium, le potassium, le calcium et le magnésium.
Les électrolytes et en particulier le sodium permettent de réguler le volume d’eau contenu dans l’organisme. Une quantité élevée d'électrolyte permet au corps d’emmagasiner davantage d’eau et donc de favoriser sa réhydratation.
Les électrolytes sont des minéraux transportant une charge électrique dans les liquides du corps (eau et sang). Leur présence maintient l’équilibre acido-basique.
Pure Electrolytes combine le savoir-faire scientifique à l'expertise du sport de haut niveau pour vous faire bénéficier de la meilleure hydratation possible.
- Contribue à maintenir la performance au cours d'un exercice d'endurance prolongé (associé à la maltodextrine)
- Contribue à accroître l'absorption d'eau durant un exercice physique (associé à la maltodextrine)
- Contribue à la fonction musculaire normale : potassium, calcium, magnésium
- Contribue au fonctionnement normal du système nerveux : potassium, magnésium, vitamine B1, B2 et C
- Contribue au métabolisme énergétique normal : calcium, magnésium, vitamine B1, B2 et C
- Contribue à réduire la fatigue : magnésium, vitamine B2 et C
- Protéger les cellules du stress oxydatif : zinc, vitamine B2 et C
- 82% des clients sont satisfaits ou très satisfaits du produit*
- 95% se sont sentis mieux hydraté pendant un effort long ou soutenu*
- 78% apprécient le goût citron de Pure Electrolytes*
- 73% ont senti une diminution des crampes*
* Étude de satisfaction réalisée auprès d'un panel de clients tirés aléatoirement

Éviter la déshydratation et les baisses de performances
En transpirant, le corps élimine jusqu’à 1,5 litres d’eau par heure. Lors d'une activité d'endurance (marathon, trail, vélo...), le corps élimine jusqu’à 3 litres d'eau par heure. La transpiration entraîne également une élimination importante de sels minéraux (votre transpiration est salée !).
Si l’alimentation quotidienne apporte suffisamment de minéraux en temps normal, une augmentation de l’activité sportive et donc de la transpiration nécessite des apports supplémentaires en sels électrolytiques.
Le taux d’électrolytes dans le corps conditionnant son taux d’hydratation, le sportif cherchera à reconstituer ces réserves en électrolytes pour faciliter sa réhydratation.
Un taux léger de déshydratation (1 à 2%) entraîne une diminution de 10% de votre capacité physique.
Pure Electrolytes va permettre une bonne hydratation et donc de maintenir un niveau de performance constant pendant l'effort.

Renforcer la fonction musculaire
La contraction musculaire permet d’assurer la motricité du corps. Cette fonction musculaire est sous le contrôle du système nerveux somatique. Le cerveau envoie des messages aux muscles sous forme de stimulation nerveuse afin qu’une contraction musculaire s’opère.
Le sodium et le potassium sont responsables de la transmission du système nerveux. Lorsque le cerveau demande au muscle de se contracter, le sodium s’écoule dans la cellule nerveuse pendant que le potassium ressort. L’inverse s’effectue lorsque le muscle se détend.
Cette stimulation nerveuse entraîne l’arrivée d’ions calcium dans les cellules musculaires permettant au muscle de se contracter et la sortie de ces mêmes ions calcium pour que votre muscle se relâche. Quant au magnésium, son rôle est de réguler l’entrée et la sortie d’ion calcium dans vos cellules musculaires.

L'importance de l'équilibre acido-basique
Déterminé par le pH, l’équilibre acido-basique de l’organisme est vital pour la santé. Les poumons, les reins utilisent le potassium, le magnésium et le calcium pour réguler le taux de pH dans le sang afin de trouver l’équilibre acido-basique.
Une alimentation riche en sucres ou une pratique sportive intense peuvent engendrer un excès d’acidité dans le sang. Pour lutter contre ce déséquilibre, l’organisme puise dans ses réserves minérales (calcium, potassium, magnésium).
Cette déminéralisation entraîne de nombreux problèmes de santé à long-terme : fragilité osseuse, arthrose, douleurs et durcissement musculaire, tension au niveau du dos et de la nuque.
Un apport en électrolyte permet de compenser cette déminéralisation.

Mieux récupérer avec les électrolytes
Des études ont permis de démontrer que les personnes transpirant à la suite d’un effort physique ou lors de fortes chaleurs, étaient toutes en déficit électrolytique (sodium, zinc, magnésium…). Le corps ne sachant pas les synthétiser, les électrolytes sont exclusivement apportés par l’alimentation et une hydratation riche en sels minéraux.
Malheureusement, il a été prouvé que l’eau seule n’est pas suffisante pour couvrir les besoins des sportifs à la suite d’une activité sportive entraînant une sudation.
Suite à un effort, une hydratation combinée à du sodium va faciliter la récupération. Le magnésium et les vitamines B2 et C vont améliorer cette récupération car ils jouent un rôle pour réduire la fatigue.
Pure Electrolytes contient tous les nutriments essentiels pour une bonne récupération.
Pure Electrolytes
Présentation générale
Les électrolytes sanguins sont des micro minéraux (minéraux dont l’organisme a besoin en grandes quantités) circulant dans l’organisme et indispensables au bon fonctionnement de ce dernier. Ces minéraux portent une charge, positive ou négative, et sont donc caractérisés comme des ions (sels, bases et acides). La présence de tels composés dans le plasma sanguin fait de ce dernier un électrolyte, conduisant le courant électrique. Les électrolytes sont essentiels à l’organisme, étant impliqués dans des phénomènes physiologiques comme de maintien de l’équilibre acido-basique et de l’osmolarité. (1)
Parmi les électrolytes sanguins, on distingue les cations, chargés positivement comme le sodium, potassium, calcium, le magnésium et les anions, chargés négativement comme le chlore ou le bicarbonate. Dans tous les liquides physiologiques, la neutralité électrique doit être maintenue, et le nombre de charges positives doit être équivalent aux charges négatives. Toutes ces propriétés leur permettent de réguler la fonction nerveuse et musculaire ainsi que de maintenir l’équilibre hydrique. (2)
Un déficit de la balance électrolytique, occasionné par différents processus comme la sudation, la déshydratation ou encore une mauvaise alimentation peut se révéler très problématique et être à l’origine de dysfonctionnements car notre corps se retrouvera en déséquilibre. En effet, les électrolytes agissent en véritable équilibre de l’organisme afin de maintenir ce dernier en fonctionnement optimal. Or, ils ne sont pas synthétisés par l’organisme et doivent être apportés en quantité suffisante via l’alimentation. (3)
Principales actions dans l'organisme
Tous les minéraux ont des rôles bien spécifiques au sein de l’organisme. Ici, il sera détaillé les fonctions de ces minéraux en tant qu'électrolytes et leur intérêt dans les fonctions physiologiques qui mettent en jeu leurs propriétés physico-chimiques. Ainsi, tous les rôles de chaque minéral ne seront pas détaillés, nous allons nous focaliser sur les propriétés électrolytiques de chacun.
Choix des formes utilisées
Tous les minéraux ont des rôles bien spécifiques au sein de l’organisme. Ici, il sera détaillé les fonctions de ces minéraux en tant qu'électrolytes et leur intérêt dans les fonctions physiologiques qui mettent en jeu leurs propriétés physico-chimiques. Ainsi, tous les rôles de chaque minéral ne seront pas détaillés, nous allons nous focaliser sur les propriétés électrolytiques de chacun.
Zinc : gluconate : est un sel de deux anions de gluconates pour un cation de zinc. C’est une forme hautement biodisponible. Sa teneur en zinc est moins élevée que dans le citrate de zinc par exemple, mais sa solubilité est bien meilleure.
Sodium : citrate & sel de Guérande (si la granulométrie du sel de Guérande le permet). Le citrate de sodium est le sel de sodium de l'acide citrique. Il a un pouvoir alcalinisant, il est donc beaucoup utilisé dans l’alimentaire pour réduire l’acidité des sodas par exemple. Dans l’organisme, on retrouve ce pouvoir alcalinisant et on peut l’utiliser dans la prise en charge des acidoses rénales.
Potassium : citrate. Pour un apport en potassium, les citrates représentent une source bien assimilable par l'organisme avec une biodisponibilité élevée.
Magnésium : citrate, c’est la forme qui a le meilleur rapport teneur/biodisponibilité. L'acide citrique, un acide organique de faible poids moléculaire, favorise l'absorption du magnésium en augmentant sa solubilité. Le citrate de magnésium est une forme bien tolérée
Calcium : citrate : forme mieux absorbée par rapport au carbonate de calcium. Le citrate de calcium est 25% mieux absorbé que le carbonate de calcium et, de plus, il ne nécessite pas de milieu acide pour être absorbé.
Propriétés du sodium
Le sodium ou Na+ est un élément prépondérant dans le sang et les liquides extracellulaires du corps. Il est le principal cation extracellulaire. Son rôle principal est le maintien de l'équilibre hydrique entre les différents compartiments de l’organisme et d’assurer une hydratation optimale des cellules.
En effet, l’eau suit des gradients de concentrations passifs. C’est à dire qu’elle passe d’un compartiment à l’autre sans dépenser d’énergie et en fonction des gradients de concentrations. Toujours, l’eau passera du milieu le moins concentré vers le milieu le plus concentré. Par exemple, lors de la sudation, le corps est déshydraté, et on a moins de sodium dans le sang par les pertes dues à la transpiration. Cependant on a aussi moins d’eau, donc les conséquences sur l’équilibre sont peu flagrantes. Il est rare qu’un athlète souffre d’hyponatrémie juste à cause de la transpiration. Le problème de la transpiration est plus la déshydratation que la perte en sodium, il faut donc s’hydrater. Cependant, ce qui peut être dangereux, c’est de s’hydrater énormément et de façon rapide juste après avoir beaucoup transpiré, car on apporte beaucoup d’eau dans le sang qui est appauvri en sodium. Cela va encore plus diluer le sodium dans le sang, et là on peut avoir des hyponatrémies et des déséquilibres électrolytiques. C’est pour cela qu’il faut s’hydrater avec des boissons supplémentées en électrolytes, pour rétablir la balance. L’eau va en quelque sorte aller “diluer” le milieu trop concentré. Ainsi, si un milieu est riche en Na+, l’eau va passer dans ce milieu qui sera alors hydraté. Dans l’exemple ci-dessus, C1<C2 de Na+, et le soluté est H2O. Ainsi en fonction des différentes concentrations de Na+ dans les différents compartiments de l’organisme, l’eau sera répartie différemment. (9)
Également, le sodium est impliqué dans la régulation de la pression artérielle au niveau rénal. Cela repose sur la propriété vue précédemment, où l’eau suit le sodium. Ainsi, grâce à certaines hormones comme la vasopressine, le sodium n’est pas éliminé et au contraire retenu dans la circulation sanguine lorsque certains récepteurs détectent une hypovolémie (lorsque le volume sanguin est bas, le débit sanguin est donc faible). Ainsi, l’eau va suivre et être retenue dans la circulation sanguine, augmentant ainsi le volume, le débit sanguin, et finalement la pression artérielle sera augmentée en conséquence.
Propriétés du potassium
Le potassium ou K+ est également l’un des principaux électrolytes sanguins. Il est le principal cation intracellulaire. Il est essentiel au fonctionnement normal des cellules, des nerfs et des muscles. Comme le sodium, il est nécessaire au maintien de l’équilibre des fluides en empêchant la fuite de l’eau hors de cellules. Son rôle principal réside dans la transmission de l’influx nerveux et dans la contraction musculaire.
Toutes les cellules ont, au repos, un potentiel de membrane appelé potentiel de repos. Sa valeur est de -70 V et est elle est due à une répartition des charges de part et d’autre de la membrane. En intracellulaire, on retrouve principalement les ions K+ qui entrent dans la cellule contre leur gradient de concentration et en extracellulaire, on retrouve principalement les ions Na+ qui sont échangés contre le potassium via une pompe ATPase. Lorsqu’un influx nerveux est transmis, le potentiel de membrane devient positif et on a une dépolarisation de la membrane cellulaire. Les canaux à sodium tensiodépendants s’ouvrent, entraînant l’entrée massive de Na+ dans la cellule. Parallèlement, les canaux K+ s’ouvrent et le potassium va sortir de la cellule. Cela va modifier la répartition des charges autour de la membrane et permettre de transmettre l’influx nerveux. Lors de la repolarisation, il y a un repompage des ions K+ vers l'intérieur de la cellule par les pompes ATPase afin de rétablir le potentiel de repos. (8)
Propriétés du magnésium
La majorité du magnésium dans l’organisme est lié aux protéines ou stocké dans les os, sous ces deux formes il est neutre et n’a pas de charge. Sous sa forme libre, le magnésium est un cation également appelé Mg2+. L’os contient environ la moitié du magnésium de l’organisme, le sang en contient très peu en réalité. Ainsi, il est essentiel à la formation des os, des dents et contribue au fonctionnement normal des nerfs et des muscles. (4)
En tant qu’électrolyte, le magnésium régule également le transfert d’autres électrolytes à travers la membrane cellulaire : les ions sodium et potassium sont concernés. Il stimule par exemple la pompe sodium/potassium (enzyme permettant l’entrée de potassium dans la cellule et la sortie de sodium). Les fonctions biologiques dépendantes de ces mouvements ioniques sont donc sensibles aux variations extracellulaires et intracellulaires du magnésium. C’est le cas de l’excitabilité cellulaire qui régit le tonus vasculaire, la vasomotricité, l’activité cardiaque et nerveuse. (5)
Le magnésium intervient également dans la transmission neuromusculaire en régulant le taux de calcium. En effet, le magnésium est l’antagoniste physiologique du calcium. Par conséquent, tous les mécanismes physiologiques impliquant des mouvements de calcium pourront être plus ou moins inhibés par une augmentation du taux de magnésium du milieu ou bien stimulés par une baisse de ce même taux. On peut citer par exemple les contractions musculaires, surtout celles qui font intervenir le calcium extracellulaire (muscle lisse et muscle strié cardiaque). Ainsi, le magnésium est capable de diminuer l’excitabilité neuronale et la transmission neuromusculaire en régulant le flux de calcium à travers la membrane.
Propriétés du calcium
Le calcium est l’élément minéral le plus abondant de l’organisme. Il représente le constituant essentiel des os et des dents et a un rôle prépondérant dans la solidité des os. Ainsi, le calcium est majoritairement présent sous forme neutre dans l’organisme. En tant qu’éléctrolyte, ce cation aussi appelé Ca2+ entre en jeu dans l’influx nerveux et la contraction musculaire. L’augmentation de la concentration de calcium est à l’origine de la contraction musculaire et sa diminution de la relaxation. Cependant les transferts de calcium diffèrent selon la nature des muscles : muscle strié cardiaque, muscle strié squelettique, muscle lisse vasculaire. (6)
(a) Dans la contraction du muscle strié cardiaque interviennent à la fois l’entrée du Ca2+ extracellulaire par des canaux de la membrane plasmique et sa libération par le réticulum sarcoplasmique.
Le calcium extracellulaire pénètre dans la cellule pendant la phase 2 ou plateau du potentiel d’action. Les canaux calciques voltage-dépendants concourent à l’élévation de la concentration de calcium intracytoplasmique des fibres myocardiques. Cette augmentation provoque un renforcement de leur contraction.
(b) Dans la contraction des muscles striés squelettiques, c’est la libération de calcium intracellulaire et sa recapture par le réticulum sarcoplasmique qui jouent le rôle essentiel; ceci est une des explications de l’absence d’effet des inhibiteurs des canaux calciques sur les muscles striés squelettiques.
Le calcium augmente la force de contraction en levant l’effet inhibiteur de la troponine : en présence de calcium, la troponine change de conformation et libère l’actine, laquelle peut interagir avec la myosine phosphorylée.
(c) Dans la contraction des fibres des muscles lisses, la pénétration du calcium extracellulaire joue un rôle plus important que son relargage par le réticulum sarcoplasmique.
Au niveau des fibres lisses vasculaires, le calcium agit essentiellement par l’intermédiaire de la calmoduline. Le calcium se combine à la calmoduline et le complexe calcium-calmoduline active la MLCK (myosin light chain kinase) en formant avec elle un complexe ternaire. Ce complexe transforme la myosine en myosine phosphorylée qui se combine à l’actine, entraînant une contraction des fibres lisses. Le complexe Ca2+/calmoduline active diverses autres enzymes. (6)
Propriétés du zinc
Le zinc est un minéral retrouvé dans les cellules de tout l’organisme. Il est un élément essentiel pour plus de 200 métalloenzymes. Il est également important pour la synthèse des acides nucléiques, de la membrane cellulaire et des protéines. De plus, il est essentiel pour la croissance, la réparation des tissus et la division cellulaire. Également, certaines études ont démontré un lien entre le zinc et l’absorption du sodium, impactant ainsi les échanges hydriques. (7)
- Au cours de l’exercice, on peut attribuer au zinc deux rôles importants :
- intervenir dans les mécanismes du stress oxydant, impliqué dans les adaptations à l’exercice, mais également les dommages musculaires ;
- Participer à la régulation de la fonction immunitaire.
Propriétés de la vitamine B1
La vitamine B1 ou thiamine est une vitamine hydrosoluble de la famille des vitamines B. Elle est métabolisée au niveau du foie où elle est transformée en TPP (pyrophosphate de thiamine), qui est la forme active de la vitamine B1. Elle est essentielle à la dégradation de l’alcool, à l’activité de nombreuses enzymes (notamment la production d’énergie à partir des glucides). Comme la plupart des vitamines, elle n’est pas synthétisée par l’organisme et un apport via l’alimentation est essentiel afin de couvrir les besoins journaliers (1.5mg par jour pour un homme adulte). (28)
Propriétés de la vitamine B2
La vitamine B2 ou riboflavine est une vitamine hydrosoluble qui joue un rôle important dans le métabolisme des nutriments (acides aminés, glucides et acides gras). Elle est complémentaire avec la vitamine B1, car elle joue un rôle dans la transformation des aliments simples (glucides, lipides, protéines) en énergie. Elle intervient également dans le métabolisme de réparation des muscles. Elle n’est également pas synthétisée par l’homme et un apport journalier de 1.4 mg par jour de vitamine B2 est recommandé pour la population générale. (28)
Propriétés de la vitamine C
La vitamine C est une vitamine essentielle pour l’organisme. Du fait de ses propriétés physico-chimiques, cette molécule acide et réductrice est impliquée dans de nombreuses réactions et à des rôles très importants dans le métabolisme énergétique, l’immunité et le piégeage des radicaux libres qui abîment nos cellules. N’étant pas synthétisée par l’homme, son apport via l’alimentation est essentiel. Cependant, étant une vitamine très fragile, il peut arriver que cet apport alimentaire soit insuffisant et une supplémentation peut s’avérer nécessaire. La dose journalière recommandée pour la vitamine C est de 110 mg par jour pour une personne adulte. (28)
L'équilibre osmotique
Les électrolytes participent au maintien de l’équilibre osmotique. Ce dernier est essentiel à l’organisme et les conséquences d’un déséquilibre peuvent être néfastes pour notre santé.
Définitions et principes
Le principe d’osmose repose sur la circulation des fluides au travers des membranes en fonction des concentrations en différentes solutés de part et d’autre de ces membranes. Ainsi, si deux solutions aqueuses ayant des concentrations salines différentes sont séparées par une membrane, l’eau passera de la solution la moins concentrée en soluté vers la solution la plus concentrée. L’eau va vouloir aller “diluer” le milieu le plus concentré afin de rétablir un équilibre entre les milieux, et conserver ce que l’on appelle l’osmose. Le flux de transfert d’eau d’un milieu à un autre est défini par la pression osmotique, force motrice de l’eau nécessaire au rétablissement de l’osmose. On appelle aussi cette pression osmotique l’osmolarité, exprimée en osmoles, qui est représentée par le nombre de particules osmotiquement actives dans une solution. (8)
L’eau représente 60% du poids corporel total, répartie de la manière suivante :
- 40% dans l’espace intracellulaire
- 20% dans l'espace extracellulaire, dont :
- 15% dans le milieu interstitiel
- 5% dans l’espace intravasculaire.
Le volume intracellulaire dépend de la pression osmotique extracellulaire, tandis que le volume extracellulaire dépend de la quantité de Na+ présent dans l’organisme. Ainsi, la pression osmotique intracellulaire est déterminée principalement par le K+ et la pression osmotique extracellulaire est déterminée principalement par le Na+.
Rôle des électrolytes dans l'équilibre hydrique
L'eau traverse les membranes cellulaires librement des régions à faible concentration en solutés vers des zones de concentration élevée en solutés. Ainsi, l'osmolalité tend à s'égaliser dans les différents compartiments liquidiens corporels, essentiellement par des mouvements d'eau, mais non de solutés. (9)
Les principaux régulateurs de l’équilibre hydrique sont le sodium et le potassium :
Le sodium : Le sodium détermine le volume extracellulaire ; une dysnatrémie (quand le taux de sodium est anormal, qu’il soit trop élevé ou trop bas). est le plus fréquemment associée à un déséquilibre du volume extracellulaire. Les valeurs normales de la natrémie (concentration de sodium dans le sang) sont d’environ 135 à 145 mmol/L.
Les mécanismes de régulation sont :
- le système rénine-angiotensine-aldostérone : l'hypovolémie stimule la libération d'angiotensine II par le biais de la rénine. L'angiotensine II provoque une vasoconstriction et stimule la libération d'aldostérone, qui favorise la réabsorption de sodium et l'excrétion de potassium, ainsi que des ions hydrogènes.
- l'ANP, dont la libération est stimulée par l'hypervolémie et l'HTA, provoque une natriurèse ;
- l'ADH, dont la libération est stimulée par l'hyperosmolarité et l'hypovolémie, favorise la réabsorption d'eau dans le canal collecteur du néphron.
Le potassium : le potassium est principalement retrouvé en intracellulaire (90% du K+ est dans nos cellules). Les valeurs normales de la kaliémie (concentration en potassium dans le sang) se situent entre 3.5 et 5 mmol/L. Son rôle dans l’équilibre hydrique est son échange avec le sodium. En effet, le corps régule les concentrations en sodium des différents compartiments de l’organisme en faisant passer le sodium d’un compartiment à un autre, et l’eau suit (1.2.1). Cependant le sodium ne passe pas toujours par diffusion passive entre les différents milieux, parfois il utilise une pompe ATPase pour passer de manière active contre son gradient ou pour augmenter l’absorption du sodium dans diverses situation (par exemple en cas d’hypovolémie). Ces pompes ATPase ont besoin d’échanger le Na+ contre un autre minéral pour fonctionner, et ce minéral est le K+. 3 Na+ sont échangés contre 2 K+. (10)
Le rein sécrète des ions potassium à chaque fois qu'il réabsorbe des ions sodium. La moindre augmentation de la concentration de potassium dans le liquide extracellulaire, stimule la libération d'aldostérone, laquelle va stimuler la réabsorption du sodium et donc l'élimination du potassium.
L'équilibre acido-basique
Les électrolytes participent également au maintien de l’équilibre acido-basique. Ce dernier est régulé par de nombreux moyens, notamment via les poumons, les reins ou les systèmes tampons. Il est déterminé par le pH et un déséquilibre peut avoir des conséquences délétères sur l’organisme.
Définitions et principes
Une caractéristique importante du sang est son pH (degré d’acidité ou d’alcalinité). L’acidité ou l’alcalinité d’une solution, y compris du sang, est exprimée grâce à l’échelle du pH. L’échelle du pH varie de 0 (très acide) à 14 (très basique ou alcalin). Un pH à 7.0, au centre de cette échelle, est neutre. Le sang est normalement faiblement basique, avec un pH qui varie entre 7,35 et 7,45 environ. L’organisme maintient habituellement le pH sanguin autour de 7,40.
L’acidité du sang augmente lorsque :
- Les taux des composants acides dans l’organisme augmentent (par l’augmentation de la prise ou de la production, ou par une diminution de l’élimination)
- Les taux de composés basiques (alcalins) dans l’organisme chutent (par une diminution de la prise ou de la production, ou une augmentation de l’élimination).
Inversement, l’alcalinité du sang augmente lorsque le taux d’acide dans l’organisme diminue ou lorsque le taux de la base augmente. (11)
L’équilibre acido basique du sang est contrôlé avec précision, car un simple petit écart de l’état normal peut sévèrement léser de nombreux organes. L’organisme utilise divers processus pour contrôler l’équilibre acido basique. Ces mécanismes impliquent différents organes :
- Les poumons : ce processus repose sur l’élimination de dioxyde de carbone par les poumons. Le dioxyde de carbone, qui est légèrement acide, est un déchet du traitement de l’oxygène et des nutriments (nécessaires à toutes les cellules) et, en tant que tel, est produit en permanence par les cellules. Il passe ensuite des cellules dans le sang. Le sang le transporte vers les poumons où il est éliminé lors de l’expiration. Si le dioxyde de carbone s’accumule dans le sang, le pH sanguin diminue (l’acidité augmente).
Le cerveau régule la quantité de dioxyde de carbone expirée en contrôlant la vitesse et l’amplitude de la respiration (ventilation). La quantité de dioxyde de carbone éliminée et, par conséquent, le pH du sang, augmentent lorsque la respiration devient plus rapide et plus profonde. En modulant la vitesse et l’amplitude de la respiration, le cerveau et les poumons régulent le pH du sang de minute en minute. - Les reins : ils peuvent modifier le pH du sang en éliminant l’excès d’acides ou de bases. Les reins ont la capacité d’altérer la quantité d’acide ou de base qui est excrétée. Toutefois, en raison du fait que les reins produisent ces adaptations de manière plus lente que les poumons, la correction du pH prend en général plusieurs jours.
- Systèmes tampons : empêchent les variations brutales d’acidité et d’alcalinité. Les systèmes tampons du pH sont des mélanges d’acides et de bases faibles naturellement produits dans l’organisme. Ces acides et ces bases faibles existent en paires qui sont en équilibre dans des conditions normales de pH. Les systèmes tampons sont des systèmes chimiques qui limitent les variations de pH d’une solution en modifiant les rapports entre acide et base. Le système tampon du sang le plus important est l’acide carbonique (un acide faible formé à partir du dioxyde de carbone dissous dans le sang) et l’ion bicarbonate (la base faible correspondante). (11)
Il existe deux anomalies de l’équilibre acidobasique :
- Acidose : il s’agit d’un excès d’acides dans le sang (ou d’un déficit en bases) qui entraîne une diminution du pH sanguin
- Alcalose : il s’agit d’un excès de bases dans le sang (ou d’un déficit en acides) qui entraîne une augmentation du pH sanguin.
L’acidose et l’alcalose ne sont pas des maladies, mais la conséquence d’une grande variété de troubles. Elles sont le signe d’un état pathologique grave. (11)
Rôles des électrolytes dans l’équilibre acido-basique
Différents électrolytes entrent en jeu dans le maintien de l’équilibre acido-basique. On retrouve notamment le potassium, le magnésium et le calcium :
(a) Rôle du calcium : plusieurs études ont démontré qu'une acidose chronique provoque une fuite de calcium à partir de l'os. (12) Ce sont les premiers à être touchés par une variation du pH sanguin. En effet, le squelette contient 99 % des réserves en calcium. Ce dernier est utilisé pour neutraliser les ions hydrogène si l'équilibre acido-basique n'est pas préservé. Les cellules osseuses sont extrêmement sensibles aux effets d'un changement de pH. L'acidose métabolique stimule l'activité des ostéoclastes, les cellules spécialisées dans la destruction de la substance osseuse et diminue parallèlement l'activité des ostéoblastes, les cellules chargées de l'élaboration de la substance osseuse fondamentale. Ainsi l'ostéoporose peut s'expliquer, pour partie, comme une conséquence du déséquilibre acido-basique. (14)
(b) Rôle du magnésium : le magnésium est le deuxième minéral mis à contribution pour servir de tampon face aux ions acides. L'organisme va encore puiser dans le squelette puisque l'os est composé de calcium mais également de 40 % de magnésium. Il entre dans la composition de plus de 3 000 enzymes dont certaines sont impliquées dans la contraction musculaire, le transport d'oxygène, la synthèse des protéines. Ainsi, une déficience en magnésium se manifeste par des crampes, des courbatures.
(c) Rôle du potassium : il va également être utilisé par l'organisme pour s'opposer à l'augmentation du pH sanguin. Le potassium aide à lutter contre l'acidification des cellules. Il joue un rôle de premier plan au niveau des reins où il va servir à pallier les effets néfastes d'une alimentation trop riche en sel, elle-même à l'origine d'une fuite de calcium osseux. Comme les réserves de potassium se trouvent dans les muscles, une déficience en potassium peut surajouter au phénomène de crampes observé en cas de déficience en magnésium. (13)
En puisant dans ses réserves minérales en calcium, en magnésium et en potassium pour neutraliser les excès d'acidité, l'organisme met en route un processus de déminéralisation entraînant une fragilité osseuse, des caries dentaires et de l'arthrose. Une sensation de douleur diffuse, de durcissement musculaire, de tension au niveau du dos, de la nuque et des articulations peuvent entraver la mobilité.
Les aliments les plus acidifiants sont le sucre blanc et les sucreries, la farine blanche et ses dérivés, les graisses durcies, les huiles raffinées, les bouillons gras, l’alcool, le café et le thé. Sont également fournisseurs d’acides, mais à un moindre degré, les viandes, les poissons, le blanc d’œuf, les fromages forts et fermentés et les légumineuses.
Les aliments alcalinisants ou générateurs de bases sont les légumes (à l’exception de l’artichaut, de l’asperge, du choux de Bruxelles, de l’oignon et du poireau), les jus et les bouillons de légumes, les fruits et leur jus (sauf l’abricot, l’orange et le pruneau), les fruits secs, les herbes aromatiques, la pomme de terre, l’amande, l’avocat, l’olive, le soja et ses dérivés, le lait, le yogourt, le fromage blanc, le jaune d’œuf et les tisanes. (15)
Fonction musculaire
La contraction est la fonction essentielle des muscles striés squelettiques, responsables des mouvements du squelette. Ces mouvements sont essentiels à l’interaction de l’organisme avec son environnement, ils sont sous le contrôle du système nerveux somatique. Les électrolytes impactent cette fonction musculaire sous différents aspects. (16)
Définitions et principes
La contraction du muscle strié squelettique est liée à l’excitation préalable des fibres musculaires par les motoneurones a. Cette excitation conduit in fine au glissement des filaments fins et épais les uns contre les autres. Les phénomènes qui se produisent entre l’excitation et la contraction sont désignés par le couplage excitation-contraction.
La genèse du potentiel d’action de fibre musculaire qui est à l’origine de la contraction s’effectue au niveau de la plaque motrice via une stimulation nerveuse. Lorsqu’un potentiel d’action arrive au niveau de la terminaison axonale, la membrane nerveuse se dépolarise. Cette dépolarisation induit l’ouverture de canaux calciques voltages-dépendants (c'est-à-dire sensible à la différence de potentiel entre la membrane plasmique du motoneurone et l’espace synaptique). Le flux de calcium à l’intérieur de la terminaison axonale déclenche une fusion des vésicules d’acétylcholine avec la membrane ce qui induit une libération de ce médiateur dans la fente synaptique. L’acétylcholine diffuse dans cette fente et va se lier à des récepteurs spécifiques situés au niveau de la membrane post-synaptique. Ces récepteurs sont des récepteurs canaux.
Ainsi la liaison de deux molécules d’acétylcholine avec le récepteur induit un changement de la conformation du récepteur qui conduit à l’ouverture du canal. Un flux d’ions sodium dans la fibre musculaire produit une dépolarisation de la membrane, on parle de potentiel de plaque motrice. Lorsque ce potentiel atteint une valeur seuil, ce potentiel induit l’ouverture de canaux sodium voltage-dépendants au niveau du sarcoplasme générant ainsi un potentiel d’action. Ce potentiel d’action se propage à la surface de la fibre musculaire dans les deux directions vers les extrémités de la fibre musculaire, la jonction neuromusculaire étant située au centre de la fibre musculaire. (16)
Rôles des électrolytes dans la fonction musculaire
Plusieurs électrolytes ont un rôle à jouer dans la contraction du muscle. Le calcium, évoqué précédemment (4.1) est l'un des principaux acteurs de la fonction du muscle. Cependant d’autres électrolytes comme le sodium, le potassium et le magnésium sont essentiels à la bonne santé de nos muscles.
(a) Le sodium et le potassium : le sodium et le potassium sont essentiels pour la fonction nerveuse. Les nerfs envoient un potentiel d’action pour ordonner aux cellules musculaires de se contracter. À l'état de repos, le sodium est à des concentrations plus élevées à l'extérieur des cellules musculaires que l'intérieur et le potassium est plus élevé à l'intérieur que dehors. Lorsqu'un nerf envoie le signal à une fibre musculaire de se contracter, le sodium s'écoule rapidement dans la cellule et, simultanément, le potassium sort de cette dernière. Ces étapes s’inversent quand un muscle se détend (le sodium se déplace hors de la cellule, et le potassium en arrière).
(b) Le calcium : dans un état détendu, le calcium est aux concentrations les plus élevées dans le réticulum sarcoplasmique. Lorsque la cellule est excitée par une impulsion nerveuse, l'afflux de sodium dans la fibre musculaire déclenche alors la libération de calcium du réticulum sarcoplasmique dans le cytoplasme de la cellule. Le calcium travaille avec des protéines spécialisées dans la cellule pour activer un processus appelé «théorie des filaments coulissants» où les protéines rampent le long de l'autre causant la contraction musculaire (4.1). Lorsque le calcium se re-déplace vers le réticulum sarcoplasmique, la fibre s'allonge à nouveau et se décontracte.
(c) Le magnésium : il rivalise avec le calcium pour interagir avec les protéines motrices dans la fibre musculaire. Au repos, le magnésium se lie aux protéines motrices à l'intérieur de la cellule et aide à l'état de relaxation. Dans l'État contracté, après la libération de calcium du réticulum sarcoplasmique, le calcium a une affinité beaucoup plus élevée pour les protéines motrices que le magnésium et, par conséquent, le déplace. Dans les conditions de pénurie de magnésium, on peut observer des crampes musculaires. (29)
Déséquilibres électrolytiques
Les électrolytes participent à de nombreux mécanismes physiologiques et permettent de maintenir l'homéostasie au sein de notre organisme. Cependant, divers facteurs peuvent être à l’origine de désordres électrolytiques, pouvant affecter notre organisme et nos performances si l’on pratique une activité sportive.
Les dangers d’une carence en électrolytes
Origine des carences électrolytiques
Il y a de nombreuses origines aux carences électrolytiques dans notre corps, qui occasionnent des déséquilibres :
La sudation intense : que ce soit à cause d’une activité physique intense ou de fortes chaleurs, la transpiration provoque une perte d’eau et par la même occasion de sodium Lorsque la température ambiante dépasse la température corporelle, la sudation est le seul mécanisme permettant de réduire la chaleur de l’organisme. Dans des situations de chaleur extérieure importante, elle peut entraîner une perte de 1,7 l d’eau par heure, soit 1000 kcal/h. Cette perte d’eau rapide s’accompagne d’une perte en sel de l’organisme. Cette perte en sel est nécessaire pour compenser ces pertes, pour conserver l’osmose, d’autant plus que la thermorégulation est prioritaire par rapport à la régulation concernant l’eau et le Na+. Même en cas de déshydratation importante, la sécrétion de sueur continue si les conditions extérieures l’exigent. Le sodium est éliminé volontairement de façon active par le corps, car comme on perd de l’eau, si on élimine pas de sodium, on sera en hypernatrémie et les cellules vont se déshydrater très rapidement (l’eau va sortir des cellules et aller dans le sang). Les pertes en chlorure de sodium (NaCl) sont d’environ de 2 à 2,5 g par litre de sueur (soit 800 à 1000 mg de sodium Na) par jour chez un sportif qui s’entraîne modérément. Les pertes sudorales en potassium étant modérées et une alimentation équilibrée couvrant les besoins journaliers (entre 3 et 5 g). Les déficiences et carences sont très exceptionnelles. (31) La pratique d’une activité sportive augmente les pertes au niveau notamment sudoral (30 à 40 mg de magnésium par litre de sueur par heure) mais aussi au niveau métabolique (réactions enzymatiques), d’où l’intérêt pour certaines personnes de réaliser des cures de magnésium marin bien assimilé généralement par l’organisme. Lors de fortes sudations, les pertes en zinc peuvent s’élever jusqu’à 5 mg/jour. Pour information, les apports nutritionnels conseillés en zinc sont de 12 mg/jour pour un homme adulte. Ainsi, on peut supposer que la complémentation en zinc pendant un effort intense, en ambiance chaude et/ou sur une durée assez longue (> 2 h) peut se révéler intéressante. (30)
La composition de la sueur varie en fonction des individus et des types d’exercices, cependant des études ont démontré qu’après un effort engendrant la transpiration, les sujets étaient tous en déficit électrolytique (notamment le sodium). Il a été également démontré qu’une simple hydratation n’était pas suffisante pour rétablir la balance, et qu’une supplémentation était nécessaire pour éviter les crampes et pouvoir continuer à s’exercer normalement ultérieurement. En effet, le remplacement des pertes en sueur est essentiel à la bonne récupération après l'effort. (17)
L’âge : en vieillissant notre corps a de plus en plus de difficultés à maintenir l’équilibre électrolytique. Cela peut s'expliquer par une réduction de la performance des reins ou d’une mauvaise alimentation (riche en aliments acides qui perturbent l’équilibre acido-basique par exemple). Également, le système digestif peut être abîmé ce qui est défavorable à l’absorption des minéraux.
Il s’agit plus d’un facteur de risque que d’une origine de déséquilibre électrolytique. Chez les personnes âgées, il a été démontré que l’hyponatrémie et l’hypokaliémie sont les anomalies électrolytiques les plus courantes. (18) Avec le vieillissement, la masse musculaire est remplacée par de la graisse. La masse hydrique totale du corps est donc diminuée et le volume intracellulaire est modifié. Tous ces facteurs jouent un rôle dans l'augmentation de la prévalence des désordres électrolytiques chez les personnes âgées.
Les problèmes digestifs : les diarrhées et vomissements provoquent des pertes hydriques très importantes. Il est essentiel de compenser ces pertes non seulement par une bonne hydratation mais également par une supplémentation en électrolytes, car ces troubles induisent une perte concomitante de ces derniers. (19)
Les problèmes rénaux : ces derniers jouant un rôle indispensable dans l'équilibre électrolytique, un dysfonctionnement occasionnera des désordres et un mauvais maintien de l'homéostasie. Les reins ne parviendront plus à maintenir l’équilibre hydrique et électrolytique. (20)
Conséquences d’une carence en électrolytes
Chaque déficit en électrolyte peut engendrer différents symptômes. Nous allons nous intéresser aux électrolytes individuellement pour décrire les symptômes de chaque carence.
Hyponatrémie : une hyponatrémie est une diminution de la concentration plasmatique de sodium < 136 mmol/L. Les manifestations cliniques sont principalement neurologiques (dues à un transfert osmotique d'eau dans les cellules cérébrales), en particulier dans l'hyponatrémie aiguë et comprennent des céphalées, une confusion et une stupeur; des convulsions et un coma peuvent survenir. Le diagnostic repose sur la mesure de la natrémie. Le dosage des ions sanguins et urinaires, l'osmolalité plasmatique et urinaire et l'évaluation du volume permettent d'en déterminer la cause. Le traitement repose sur la réduction de l'apport hydrique, une augmentation des sorties hydriques, une suppléance de tout déficit de sodium et le traitement du trouble sous-jacent. (21)
Hypokaliémie : L'hypokaliémie est une concentration sérique du potassium 3,5 mmol/L causée par un déficit des stocks de K+ corporels totaux ou par un déplacement anormal du potassium vers l'intérieur des cellules. La cause la plus fréquente est une perte rénale et digestive excessive. Les symptômes cliniques comprennent une faiblesse musculaire et une polyurie; une hyperexcitabilité cardiaque peut survenir en cas d'hypokaliémie sévère. Le diagnostic repose sur la mesure du potassium sérique. Le traitement consiste en l'administration de potassium et le traitement de la cause de l’hypokaliémie. (22)
Hypocalcémie : l’hypocalcémie représente la concentration plasmatique totale de calcium < 2,20 mmol/L en présence d'une concentration normale des protéines plasmatiques ou d'un calcium plasmatique ionisé < 1,17 mmol/L. Les causes les plus fréquentes en sont l'hypoparathyroïdie, la carence en vitamine D et les néphropathies. Les symptômes comprennent des paresthésies, la tétanie et, s'ils sont graves, des convulsions, une encéphalopathie et une insuffisance cardiaque. Le diagnostic implique la mesure de calcémie avec ajustement sur la concentration d'albumine sérique. Le traitement consiste dans l'administration de calcium, parfois associé à de la vitamine D. (23)
Hypomagnésémie : L'hypomagnésémie correspondant à une concentration sérique de magnésium < 0,70 mmol/L. Les causes comprennent un apport et une absorption en magnésium inadéquats ou une excrétion accrue due à une hypercalcémie ou à des médicaments tels que les diurétiques. Les signes cliniques sont souvent dus à une hypokaliémie associée et à une hypocalcémie et comprennent une léthargie, des tremblements, une tétanie, des convulsions et des troubles du rythme. Le traitement repose sur un apport de magnésium. (24)
Contre-indications et effets indésirables
Les effets indésirables des solutions d’électrolytes sont les effets inverses des conséquences d’une carence. Ainsi, si la prise d’électrolytes est excessive, on aura les effets opposés : hyperkaliémie, hypernatrémie, hypercalcémie et hypermagnésémie qui sont aussi délétères pour l’organisme.
Hypernatrémie : l'hypernatrémie est une concentration de sodium sérique 145 mmol/L. Elle implique un déficit de l'eau corporelle totale par rapport au sodium corporel total causé par une consommation d'eau inférieure aux pertes d'eau. Le symptôme majeur en est la soif ; les autres manifestations cliniques sont principalement neurologiques (liées à un transfert osmotique d'eau en dehors des cellules), et comprennent une confusion, une hyperexcitabilité neuromusculaire, des convulsions et de façon plus extrême, un coma. Le diagnostic repose sur la mesure du sodium plasmatique et parfois sur d'autres examens. (25)
Hyperkaliémie : l'hyperkaliémie est une concentration sérique de potassium > 5.5 mmol/L, résultant généralement d'une diminution de l'excrétion de potassium au niveau rénal ou d'un déplacement anormal de potassium hors des cellules. Habituellement, plusieurs facteurs favorisants simultanés concourent à l'hyperkaliémie, y compris les apports accrus de potassium, les médicaments qui altèrent l'excrétion rénale de potassium et les maladies ou lésions rénales aiguës ou chroniques. Une hyperkaliémie peut également survenir dans l'acidose métabolique comme dans l'acidocétose diabétique. Les manifestations cliniques sont généralement neuromusculaires, induisant une faiblesse musculaire et des effets cardiotoxiques qui, s'ils sont sévères, peuvent dégénérer en une fibrillation ventriculaire ou une asystolie. Le diagnostic repose sur la mesure de la kaliémie. (26)
Hypercalcémie : l'hypercalcémie correspond à une calcémie totale > 2,60 mmol/L ou un calcium sérique ionisé > 1,30 mmol/L. Les principales causes comprennent l'hyperparathyroïdie, l'intoxication par la vitamine D et le cancer. Les caractéristiques cliniques comprennent une polyurie, une constipation, une faiblesse musculaire, une confusion et un coma. Le diagnostic repose sur le dosage du calcium plasmatique ionisé. (23)
Hypermagnésémie : l'hypermagnésémie correspond à une concentration de magnésium > 1,05 mmol/L. La principale cause en est l'insuffisance rénale. Les symptômes comprennent une hypotension, une dépression respiratoire et dans les formes graves un arrêt cardiaque. Le diagnostic repose sur la mesure de la concentration sérique du magnésium. (27)
Il faut garder à l’esprit que ces troubles surviennent majoritairement en cas de dysfonctionnement d’un système physiologique comme les reins ou la thyroïde. Ainsi, une supplémentation raisonnable aux doses indiquées sur le site NUTRIPURE est sans danger pour une personne adulte en bonne santé. Cependant, il faut rester vigilant en cas d’altération de la fonction rénale ou de problèmes hormonaux qui pourraient prédisposer à une surcharge électrolytique.
Conclusion générale
Les électrolytes sont donc les principaux acteurs du maintien de l'homéostasie de l’organisme. Ces minéraux sont essentiels au bon fonctionnement de l’organisme et sont apportés exclusivement par l’alimentation et l’hydratation, n’étant pas synthétisés par notre corps. Individuellement, ils ont chacun des propriétés qui leurs sont propres et qui les caractérisent, mais ils agissent également de concert afin de réguler l’équilibre hydrique, acido-basique et la fonction musculaire.
Ces éléments sont essentiels et rapidement, en cas de forte chaleur ou d’activité physique intense, ils peuvent se retrouver en carence. C’est pourquoi il est pertinent de proposer une supplémentation en électrolytes pour les personnes à risque de carence, l’hydratation seule étant parfois insuffisante pour pallier au manque d’électrolytes. Afin d’apporter une supplémentation complète, ces électrolytes sont couplés avec des minéraux et vitamines essentiels comme le zinc, la thiamine, la riboflavine ou la vitamine C.
Bibliographie
(1) Dr Nadine Oboa. 2016. Les solutés de perfusion et les électrolytes. IFSI Charles Foix, Jean Ronstand.
(2) James L. Lewis. 2020. Présentation des électrolytes, Manuel MSD.
(3) ANSES. 2017. Les minéraux.
(4) A. Pointillart, L. Gueguen. 1978. Relations physiologiques entre le magnésium et l’os. Annales de biologie animale, biochimie, biophysique 18 (6), p.1247-1271.
(5) Magalie AVENSAC. 2018. Le magnésium dans la prise en charge du stress à l’officine. p10-13.
(6) Pierre Allain. 2000. Pharmacologie, les Médicaments, Troisième édition.
(7) Ghishan, Fayez K. 1984. Transport d'électrolytes, d'eau et de glucose en cas de carence en zinc, Journal of Pediatric Gastroenterology and Nutrition - Volume 3 - Numéro 4 - p 608-612
(8) James L. Lewis. 2020. Présentation du rôle du potassium dans l’organisme. Manuel MSD.
(9) James L. Lewis. 2020. Équilibre hydrique et sodé. Manuel MSD, Version pour professionnels de la santé.
(10) IFSI. 2018. L'équilibre hydrique, électrolytique et acido-basique.
(11) James L. Lewis. 2020. Généralités sur l’équilibre acidobasique. Manuel MSD, version pour le grand public.
(12) Remya Rajan, Kripa Elizabeth Cherian, John Mathew, Hesarghatta Shyamsunder Asha, Nitin Kapoor, Thomas Vizhalil Paul. 2021. Ostéomalacie consécutive à une acidose tubulaire rénale au cours d’un syndrome de Gougerot-Sjögren. Revue du Rhumatisme.
(13) F. Stucker, P. Saudan, E. Feraille, P-Y. Martin. 2007. Rev Med Suisse, volume 3, 32112.
(14) Université Médicale Virtuelle Francophone. 2011. Item 319, Hypercalcémie.
(15) Christian Demigné, Marie-Jeanne Davicco & Véronique Coxam, Fonds Français Alimentation et Santé. 2013. État des lieux : alimentation et équilibre acido-basique.
(16) Institut de myologie. 2020. Mécanismes de la contraction.
(17) Maughan RJ, Shirreffs SM. 1997. Recovery from prolonged exercise: restoration of water and electrolyte balance. J Sports Sci. 15(3):297-303.
(18) Schlanger, Lynn E et coll. 2010. «Électrolytes dans le vieillissement.» Progrès de la maladie rénale chronique vol. 17,4 (2010): 308-19.
(19) ABREGE D’HEPATO-GASTRO-ETROLOGIE- 2ème édition - Partie « Connaissances » - Octobre 2012 par la CDU-HGE - Editions Elsevier-Masson.
(20) Yolanda Smith. Jun 2019. Bruit et insuffisance rénale aiguë d’électrolyte, News medical life Sciences.
(21) Horacio J. Adrogué, MD, et Nicolaos E. Madias, MD. 2000. Hyponatremia, The New England Journal of Medicine.
(22) F. John Gennari, M.D. 1998. Hypokalemia, The New England Journal of Medicine.
(23) Patricia A. Schenck, Dennis J. Chew, Larry Allen Nagode, and Thomas J. Rosol. 2006. Disorders of calcium, hypercalcemia and hypocalcemia. Chapter 6, p. 122-194.
(24) Zalman S. Agus. 1999. Hypomagnesemia, Journal of the American Society of Nephrology.
(25) Horacio J. Adrogué, M.D., and Nicolaos E. Madias, M.D. 2000. Hypernatremia. The New England Journal of Medicine.
(26) JOYCE C. HOLLANDER-RODRIGUEZ, M.D., and JAMES F. CALVERT, JR., M.D., 2006. Hyperkalemia. Oregon Health & Science University, 73(2):283-290.
(27) James W. Van Hook, MD. Jan 199. Hypermagnesemia. Volume 7, issue 1, p215-223.
(28) Larry E. Johnson. MD, PhD. 2019. Revue générale sur les vitamines. Manuel MSD, Version pour les professionnels de santé
(29) Michael I. Lindinger and George J. F. Heigenhauser. 1991. The roles of ion fluxes in skeletal muscle fatigue. Canadian Journal of Physiology and Pharmacology. 69(2): 246-253.
(30) Nicolas AUBINEAU. 2021. Transpiration et sport. Diététicien Nutritionniste du sport et en clinique.
(31) The Electrolyte Composition of Normal Adult Sweat1, 2." American Review of Respiratory Disease, 93(1), pp. 62–69
Composition
Saveur citron
Sucre de canne, citrate de potassium, citrate de calcium, citrate de magnésium, sel de mer non raffiné, citrate de sodium, arôme naturel de citron, gluconate de zinc, vitamine C (acide ascorbique), vitamine B2 (riboflavine), vitamine B1 (chlorhydrate de thiamine).
Nous effectuons un nettoyage minutieux contre les allergènes entre chaque production, il subsiste néanmoins un risque de présence d'allergènes avec des traces possibles de : lait.
Saveur fruits rouges
Sucre de canne, citrate de potassium, citrate de calcium, citrate de magnésium, sel de mer non raffiné, citrate de sodium, arômes naturels fruits rouges, colorant : jus de betterave (maltodextrine), gluconate de zinc, vitamine C (acide ascorbique), vitamine B2 (riboflavine), vitamine B1 (chlorhydrate de thiamine).
Nous effectuons un nettoyage minutieux contre les allergènes entre chaque production, il subsiste néanmoins un risque de présence d'allergènes avec des traces possibles de : lait.
Dénomination légale
Préparation en poudre pour boisson à base d'électrolytes, saveur citron.
Informations Nutritionnelles
Saveur citron
| Informations nutritionnelles | Pour 100g de poudre | Pour une dose (10g) | %AR* par dose |
|---|---|---|---|
| Énergie | 1087 kJ / 256 kcal | 109 kJ /26 kcal | 1,3 |
| Matières grasses | 0,0g | 0,0g | 0,0 |
| Dont acides gras saturés | 0,0g | 0,0g | 0,0 |
| Glucides | 64g | 6,4g | 2,5 |
| Dont sucres | 63g | 6,3g | 2,5 |
| Fibres alimentaires | 0,2g | 0,0g | 0,0 |
| Protéines | 0,0g | 0,0g | 0,0 |
| Sel | 7,7g | 0,77g | 13,3 |
| Vitamines et sel minéraux | %AR* | ||
| Vitamine B1 | 1,7mg | 0,17mg | 15 |
| Vitamine B2 | 2,1mg | 0,21mg | 15 |
| Vitamine C | 122mg | 12mg | 15 |
| Sodium | 3070mg | 307mg | |
| Potassium | 4032mg | 403mg | 20 |
| Calcium | 1639mg | 163mg | 20 |
| Magnésium | 1020mg | 102mg | 27 |
| Zinc | 51mg | 5,1mg | 51 |
Saveur fruits rouges
| Informations nutritionnelles | Pour 100g de poudre | Pour une dose (10g) | %AR* par dose |
|---|---|---|---|
| Énergie | 1076 kJ / 253 kcal | 108 kJ /25 kcal | 1,3 |
| Matières grasses | 0,0g | 0,0g | 0,0 |
| Dont acides gras saturés | 0,0g | 0,0g | 0,0 |
| Glucides | 63g | 6,3g | 2,5 |
| Dont sucres | 62g | 6,2g | 2,5 |
| Fibres alimentaires | 0,2g | 0,0g | 0,0 |
| Protéines | 0,0g | 0,0g | 0,0 |
| Sel | 7,7g | 0,77g | 13,3 |
| Vitamines et sel minéraux | %AR* | ||
| Vitamine B1 | 1,74mg | 0,17mg | 16 |
| Vitamine B2 | 2,08mg | 0,21mg | 15 |
| Vitamine C | 123mg | 12,3mg | 15 |
| Sodium | 3072mg | 307mg | - |
| Potassium | 4021mg | 402mg | 20 |
| Calcium | 1659mg | 166mg | 21 |
| Magnésium | 1068mg | 107mg | 28 |
| Zinc | 57,4mg | 5,74mg | 57 |
Conditionnement
15 sachets de 10g.
Transparence
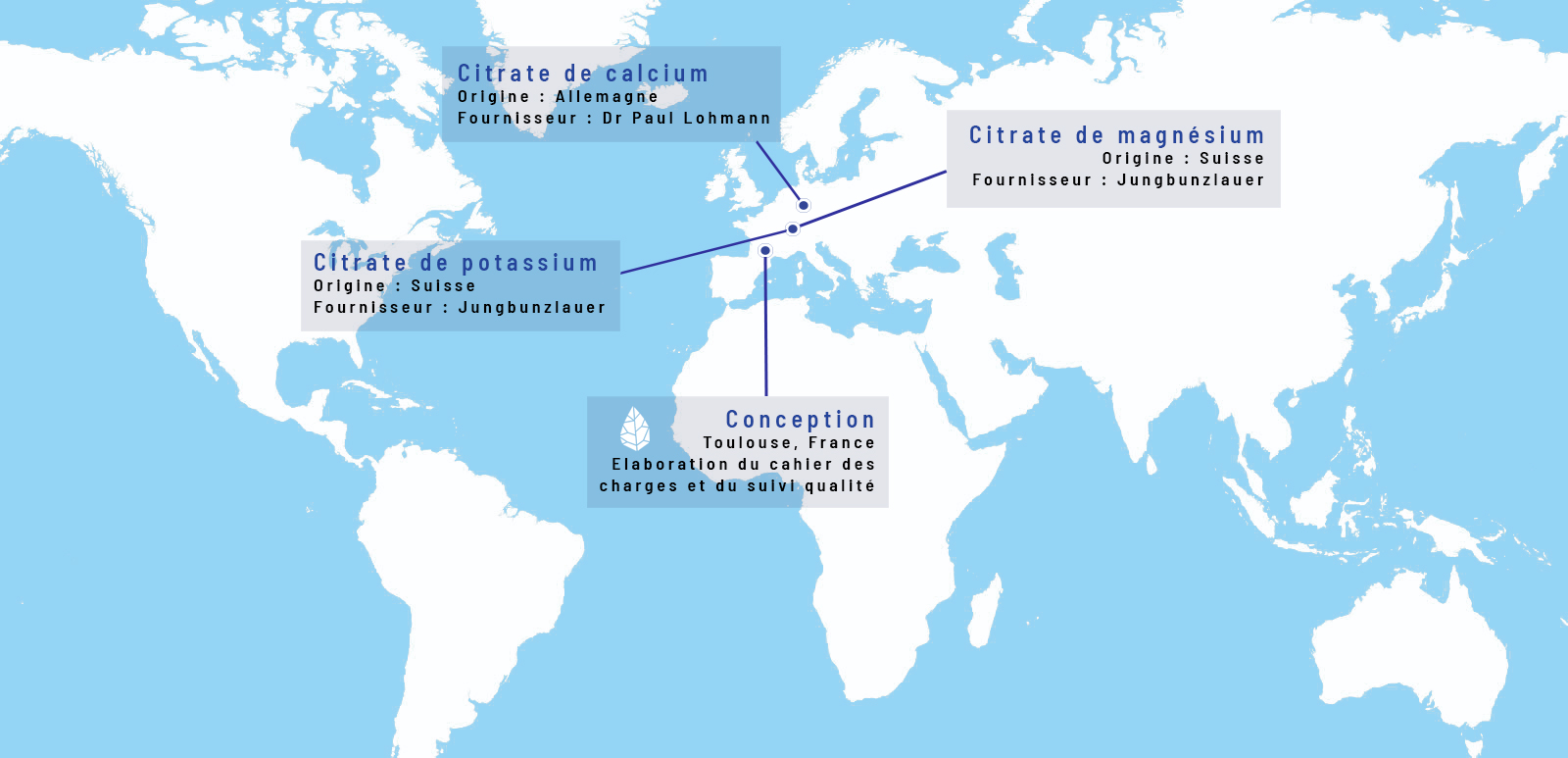
Avertissements
Déconseillé aux femmes enceintes ou allaitantes. Réservé à l'adulte. Tenir hors de portée des enfants. Ne pas utiliser à la place d'un régime alimentaire varié et équilibré et d'un mode de vie sain. Il est indispensable de boire au moins 1,5L d'eau dans le journée.
Conseils d'utilisation
Pour les efforts courts (moins de 1h30)
Les électrolytes sous forme de boisson sont particulièrement adaptés pour les efforts où la transpiration est importante. C’est le cas des sports d’intérieur tels que la musculation, le crossfit et les sports d’endurance de moins de 1h30 comme la course à pied, le VTT… L'apport en minéraux, en plus du léger apport en sucres (6g par sachet), est idéal pour améliorer votre récupération.
![]() Diluer 1 sachet d’électrolytes dans 500ml à 800ml d’eau et buvez votre boisson tout au long de l’activité physique, par petites gorgées.
Diluer 1 sachet d’électrolytes dans 500ml à 800ml d’eau et buvez votre boisson tout au long de l’activité physique, par petites gorgées.
Recommandations d'hydratation
- 500ml par heure d’effort pour des températures inférieures à 10°C
- 600-700ml par heure d’effort pour des températures comprises entre 10°C et 20°C
- 800ml à 1L par heure d’effort pour des températures supérieures à 20°C
Pour les efforts longs (plus de 1h30)
Lors d’un effort long (marathon, trail, triathlon, vélo), votre corps a non seulement besoin d’être hydraté mais il a aussi besoin d’énergie sous forme de glucides. Associés à la maltodextrine, les électrolytes s’avèrent être une combinaison optimale pour maintenir vos performances et augmenter l’absorption de l’eau dans votre organisme.
![]() Diluer 1 sachet d’electrolytes dans 500 à 800ml d’eau + 50g de maltodextrine et buvez votre boisson tout au long de l’activité physique, par petites gorgées.
Diluer 1 sachet d’electrolytes dans 500 à 800ml d’eau + 50g de maltodextrine et buvez votre boisson tout au long de l’activité physique, par petites gorgées.
Recommandations d'hydratation
- 500ml par heure d’effort pour des températures inférieures à 10°C
- 600-700ml par heure d’effort pour des températures comprises entre 10°C et 20°C
- 800ml à 1L par heure d’effort pour des températures supérieures à 20°C
Le climat
La prise d’électrolytes n’est pas uniquement réservée aux sportifs. En effet, lors de fortes chaleurs comme les canicules, la sudation entraîne la perte de précieux minéraux. Pour éviter la déshydratation, votre corps a besoin d’eau mais également d’un apport en électrolytes pour assurer le bon fonctionnement de votre organisme.
![]() Diluer 1 sachet d’electrolytes dans 1 grand verre d’eau (environ 250ml).
Diluer 1 sachet d’electrolytes dans 1 grand verre d’eau (environ 250ml).
En voyage
Que vous vous déplaciez pour le plaisir ou pour le travail, voyager multiplie les risques de déshydratation. La cause principale est l’air particulièrement sec circulant dans les transports (bus, train, avion), les aéroports, ou les problèmes gastriques (exemple : tourista). Une boisson à base d'électrolytes vous fera le plus grand bien pour lutter contre les symptômes de la déshydratation.
![]() Diluer 1 sachet d’électrolytes dans votre gourde ou bouteille d’eau (environ 500ml).
Diluer 1 sachet d’électrolytes dans votre gourde ou bouteille d’eau (environ 500ml).
Une boisson à base d'électrolytes est idéale pour maximiser votre hydratation.
En plus de consommer des électrolytes dans vos aliments de tous les jours, vous pouvez aussi consommer des électrolytes sous forme de compléments alimentaires. Ils ont l'avantage d'être bien dosés pour vous apporter tous les électrolytes dont vous avez besoin pour une hydratation et récupération maximlae.
Les électolytes se trouvent naturellement dans de nombreux aliments du quotidien. On les trouve notamment dans les oeufs, les oléagineux (cacahuètes, amande...), les légumes verts (petits poids, brocoli)...
Les électrolytes sont des minéraux qui jouent un rôle très important dans l'organisme. En effet, ils vous permettent de contracter vos muscles, régulent l'équilibre acido-basique si important pour votre corps et maintiennent l'osmose au sein de votre organisme (c'est-à-dire l'hydratation optimale de votre corps). Les électolytes vont donc améliorer l'absorption globale de l'eau par votre corps.